Embolie pulmonaire
L'embolie pulmonaire (EP) consiste en une obstruction mécanique endovasculaire de la vascularisation pulmonaire. [1]
Épidémiologie
Dans la population générale, l'épidémiologie de l'EP est difficile à déterminer en raison des présentations très variées et des formes subcliniques.
L'incidence de l'EP varie de 39 à 115 pour 100 000 habitants par an [1]. Pour la thrombose veineuse profonde (TVP), l'incidence varie de 53 à 162 pour 100 000 personnes [2]. Les adultes sont de loin les plus touchés. Après l'infarctus du myocarde et l'accident vasculaire cérébral, l'EP aiguë se classe au troisième rang des causes principales de maladie cardiovasculaire. [3] On observe une incidence plus élevée d'EP chez les hommes que chez les femmes.
Dans la population hospitalisée, autant chirurgicale que médicale, 51,8 % des patients sont à risque d'événements thromboemboliques[4]. Dans l'ensemble, la mortalité liée à l'EP est élevée : aux États-Unis, l'EP provoque plus de 100 000 décès par an[5]. Cependant, il est important de noter que le taux de mortalité par EP a diminué, possiblement en raison de l'amélioration des modalités diagnostiques et de l'initiation d'interventions et de thérapies précoces.[1]
Étiologies
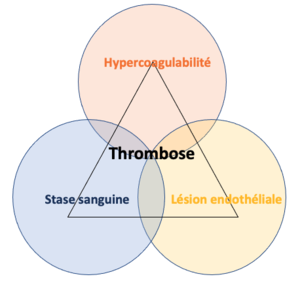
L'EP est d'origine multifactorielle. Aucun facteur déclencheur n'est identifié dans le tiers des cas de thrombo-embolies veineuses (TEV) [1][6][7]. Les embolies pulmonaires proviennent majoritairement des TVP (80 %) des membres inférieurs, mais divers éléments passant dans la circulation pulmonaire, tels que l'air, la graisse ou les cellules tumorales, peuvent aussi être en cause[8][1]. Les facteurs de risque clés de la thrombose peuvent se regrouper sous trois principales catégories (triade de Virchow) [1]:
- La stase sanguine : les conditions empêchant le retour veineux comme l'alitement prolongé et l'immobilisation.
- Les lésions endothéliales : les atteintes causant une dysfonction ou des dommages à l'endothélium vasculaire comme dans le contexte de sepsis, d'utilisation de cathéter veineux central, de trauma ou de chirurgie.
- L'hypercoagulabilité : les désordres de la coagulation, incluant les thrombophilies héréditaires, la grossesse, la prise d'œstrogènes ou un cancer actif.
Dans le cas des TEV, les facteurs les plus importants sont en lien avec la stase sanguine ainsi que l'augmentation de la coagulation [9].
Les sites les plus communs de TVP sont les veines des membres inférieurs, (iliaques, fémorales, poplitées), particulièrement au niveau des bifurcations ou des cuspides valvulaires étant donné la stase sanguine à ces endroits. D'autres sites de TVP sont également possibles dont les veines pelviennes et rénales, la veine cave inférieure ou encore les veines situées dans les membres supérieurs [10][11][12][13].
Physiopathologie
Les embolies pulmonaires sont généralement multiples et leur impact dépend de leur taille. Les emboles de taille importante ont tendance à obstruer l'artère pulmonaire principale pouvant provoquer une embolie en selle avec des conséquences cardiovasculaires délétères. En revanche, des emboles de plus petite taille bloquent les artères périphériques et ont donc un impact hémodynamique moindre.
Jusqu'à environ 10 % des patients pourraient subir un infarctus pulmonaire.[1] Celui-ci peut se manifester sous forme d'hémoptysies.
Les patients qui ont une atteinte périphérique sont plus susceptibles d'avoir une douleur pleurétique étant donné l'inflammation de la plèvre adjacente.[14]
Conséquences respiratoires
L'embolie pulmonaire peut résulter en une insuffisance respiratoire hypoxémique ou mixte [1]. Le tout découle de :
- l'augmentation de l'espace mort : perte de la vascularisation au niveau de régions ventilées, prévenant ainsi les échanges gazeux
- l'inhomogénéité du rapport ventilation/perfusion (V/Q) : perte de l'équilibre physiologique entre la ventilation (V) et la perfusion (Q) prévenant les échanges gazeux. Il en résulte une atteinte de la vascularisation dans le contexte d'une ventilation alvéolaire préservée.
La libération de médiateurs inflammatoires provoque également un vasospasme, ce qui résulte en une atteinte supplémentaire de la perfusion. L'inflammation peut également entraîner des atélectasies causée par la diminution du surfactant et l'œdème interstitiel secondaire, se traduisant ainsi en une atteinte de la ventilation au niveau des régions ayant une perfusion normale. Ce phénomène exacerbe l'inhomogénéité V/Q, voire crée un shunt pulmonaire.[15]
Conséquences hémodynamiques
L’obstruction des artères pulmonaires résulte en une augmentation de la pression de la vascularisation pulmonaire. Ce phénomène peut être exacerbé par l'inflammation secondaire. Il en découle une surcharge de pression du ventricule droit de sévérité variable. Le tout peut se manifester par une insuffisance cardiaque droite aiguë (cor pulmonale) et dans les cas sévères, par une instabilité hémodynamique pré-charge dépendante.[1]
Le choc obstructif s'explique par la perte de la pré-charge du ventricule gauche secondairement à l'obstruction significative du flot pulmonaire. Le choc peut être exacerbé par tout facteur diminuant la pré-charge, incluant l'hypovolémie et l'intubation endotrachéale (diminution du retour veineux par l'augmentation des pressions intra-thoraciques).
Présentation clinique
Facteurs de risque
| Catégorie | Facteurs de risque | |
|---|---|---|
| Acquis | Hypercoagulabilité |
|
| Dommage vasculaire |
| |
| Stase veineuse |
| |
| Héréditaires | ||
Les facteurs de risque les plus importants sont identifiés par un (+). À retenir que la classification proposée selon la triade de Virchow demeure imparfaite : certains facteurs de risque (par exemple un trauma, une néoplasie, etc.) peuvent atteindre plusieurs composantes de la triade.
Finalement, un antécédent personnel ou familial (+) de thrombo-embolie veineuse est aussi un facteur de risque clé. Il ne faut pas oublier qu'environ 30 % des EP ne sont pas provoquées, c'est-à-dire qu'aucun facteur de risque n'est identifié. [6]
Questionnaire
La présentation clinique de l'EP est extrêmement variable en fonction de nombreux facteurs dont la sévérité de l'atteinte ainsi que la fonction cardiopulmonaire du patient. Les symptômes sont parfois peu spécifiques, voire absents. Les symptômes les plus fréquents sont [6][20][21][22]:
- la dyspnée [Pr: 79 %]
- celle-ci peut être au repos [Pr: 61 %] ou à l'effort [Pr: 16 %]
- elle est souvent d'apparition rapide : des secondes (41 %) ou des minutes (26 %)
- elle est parfois d'apparition plus graduelle : des heures (14 %) ou des jours (19 %)
- des symptômes de thrombose veineuse profonde [Pr: 39-42 %][note 2]
- une douleur thoracique pleurétique [Pr: 47 %]
- une douleur thoracique non pleurétique [Pr: 17 %]
- une toux [Pr: 43 %]
- des hémoptysies [Pr: 13 %]
- une syncope (< 10%)
- des symptômes non spécifiques, tels que des étourdissements, de la fatigue, des palpitations et de l'anxiété.
Examen clinique
À l'examen physique, il est possible de trouver les signes suivants [6][21]:
- aux signes vitaux[note 3]
- une tachypnée [Pr: 57 %]
- une tachycardie [Pr: 26 %]
- une désaturation
- une hypotension artérielle
- des signes de choc obstructif, dans les cas d'embolie pulmonaire massive
- à l'examen pulmonaire :
- des crépitants [Pr: 21 %]
- le murmure vésiculaire diminué [Pr: 21 %] (atélectasie)
- à l'examen cardiaque :
- des signes de thrombose veineuse profonde [Pr: 47 %].
Examens paracliniques
Les examens paracliniques vont varier selon nos hypothèses diagnostiques ainsi qu'en fonction de notre indice de suspicion de l'EP. Le défi de l'investigation d'une TEV suspectée est de distinguer rapidement les patients ayant besoin d'un examen d'imagerie avancée de ceux qui n'en auront pas besoin. Les tests ultérieurs vont dépendre de plusieurs facteurs qui sont décrits dans la section « approche clinique ».
Laboratoires
Les examens de laboratoire comprennent [1][23][24] :
- une formule sanguine complète (FSC)
- une créatininémie
- l'INR/TCA (en prévision de l'anticoagulation)
- des troponines et des pro-BNP
- à la fois pour le diagnostic différentiel de la douleur thoracique et de la dyspnée, ainsi que pour évaluer la souffrance du ventricule droit
- l'ECG, ce qui permet :
- d'évaluer le diagnostic différentiel (particulièrement utile chez les gens qui se présentent pour une syncope)
- d'identifier certains critères suspects d'une EP, reflétant la surcharge de pression et le stress résultant sur le ventricule droit :
- la tachycardie sinusale(plus fréquent)
- des anomalies du segment ST et des anomalies de l'onde T, typiquement en V1 à V3
- S1Q3T3(plus grande spécificité, mais peu fréquent)
- une déviation axiale droite
- un bloc de branche droit incomplet de novo
- un gaz veineux, capillaire ou artériel :
- L'alcalose respiratoireest typiquement présente dans les cas de sévérité moindre.
- Un gradient alvéolo-artériel augmenté.
- L'hypoxémie inexpliquée avec une radiographie thoracique normale devrait soulever la suspicion clinique d'EP.
- L'hypercapnie, l'acidose respiratoire ou l'acidose lactique ne sont pas fréquente, mais peuvent être présentes chez les patients atteints d'EP massive associée à un choc obstructif.
D-dimères
Les D-dimères sont un produit de dégradation de la fibrine. Ainsi, les niveaux de D-dimères s'élèvent dans le plasma chaque fois qu'il y a un processus thrombotique aigu dans le corps en raison de l'activation simultanée des voies de coagulation et de fibrinolyse.
Ce test a une sensibilité d'au moins 95 %, donc une valeur prédictive négative élevée.[25] Par conséquent, un niveau normal de D-dimères rend improbable une EP ou une TVP aiguë. Toutefois, comme la valeur prédictive positive des niveaux élevés de D-dimères est faible, le test de D-dimères n'est pas utile pour la confirmation de l'EP; il est donc utilisé principalement chez le patient avec une probabilité pré-test faible afin d'exclure le diagnostic d'embolie pulmonaire.
Il faut toutefois noter que la spécificité du D-dimère diminue avec l'âge pour atteindre environ 10 % chez les patients de plus de 80 ans.[26][27] L'utilisation de seuils ajustés en fonction de l'âge pour les patients âgés de plus de 50 ans peut améliorer les performances du test D-dimères chez les personnes âgées. La formule pour ajuster le seuil selon l'âge est :
- (Âge en années) x 10 mcg/L pour les patients de plus de 50 ans [27].
- Si < 50 ans, utilisation du seuil standardisé de > 500 ng/mL.
L'utilisation du seuil ajusté en fonction de l'âge au lieu du seuil standard de D-dimères ( > 500 ng/mL) a augmenté le nombre de patients chez lesquels la possibilité d'EP pouvait être exclue de 6,4 % à 30 % sans faux négatifs supplémentaires.[26]
Il faut aussi noter que certains facteurs peuvent amener un résultat faussement positif, notamment [1][26]
- le statut post-opératoire
- un traumatisme
- un contexte infectieux
- un infarctus
- un désordre hépatique
- certains cancers
- la grossesse
- l'âge avancé
- l'arthrite rhumatoïde.
Imagerie
| Imagerie | Commentaires |
|---|---|
| Angio-TDM pulmonaire[Se: 0.83 %[28]][Sp: 0.96 %[29]][VPP: 0.92 %[30]][VPN: 0.96 %[31]] |
|
| Scintigraphie de ventilation/perfusion |
|
| Échocardiographie transthoracique (ETT) |
|
| Angiographie pulmonaire |
|
| Échographie doppler des membres inférieurs |
|
| Radiographie pulmonaire |
|
| Scintigraphie tomographique de ventilation/perfusion[Se: 0.96 %][Sp: 0.97 %] [43] |
Thrombophilie
Les indications pour rechercher une thrombophilie demeure controversée. Elles incluent :
- l'âge < 50 ans
- la maladie thrombo-embolique non-provoquée avec antécédents familiaux
- une thrombophlébite à un site inhabituel
- une maladie thrombo-embolique récidivante, typiquement lorsque non-provoquée
Le bilan de thrombophilie comprend la recherche des pathologies suivantes :
- le syndrome des antiphospholipides (SAPL)
- la mutation JAK2
- le déficit en antithrombine III
- l'hémoglobinurie paroxystique nocturne (HPN)
- l'homocystéinémie : rarement d'emblée, selon la clinique
- le facteur V de Leiden (congénital)
- la mutation G20210A de la prothrombine.
Approche clinique
Une fois l'EP suspectée, la première étape consiste à la classer en fonction de la présence ou de l'absence de stabilité hémodynamique. C'est une étape cruciale, car les étapes subséquentes vont en dépendre. [1]
L'EP hémodynamiquement stable regroupe les EP légèrement symptomatiques ou asymptomatiques (EP à faible risque), allant de celles provoquant une légère hypotension qui se stabilise en réponse à la thérapie liquidienne jusqu'à celles qui présentent un dysfonctionnement du ventricule droit (embolie submassive ou EP à risque intermédiaire) avec stabilité hémodynamique préservée. [1]
L'EP hémodynamiquement instable (aussi appelée EP massive ou à haut risque) se définit comme une EP qui entraîne une hypotension, soit [1]:
- une pression artérielle systolique (PAS) inférieure à 90 mmHg ou
- une baisse de la PAS de 40 mm Hg ou plus par rapport à la valeur de départ ou
- une hypotension nécessitant vasopresseurs ou inotropes.
L'ancien terme EP « massif » ne décrit pas la taille de l'EP, mais plutôt son effet hémodynamique. Les patients présentant une EP instable sur le plan hémodynamique sont plus susceptibles de mourir d'un choc obstructif (c'est-à-dire d'une insuffisance ventriculaire droite sévère).[1]
La Société européenne de cardiologie (European Society of Cardiology ou ESC) sépare les patients en trois catégories de risque[45] :
- risque élevé : instabilité hémodynamique
- risque intermédiaire
- intermédiaire à haut risque : sévérité clinique avec élévation des troponines et dysfonction du cœur droit à l'imagerie
- intermédiaire à faible risque : sévérité clinique (en absence d'instabilité hémodynamique)
- risque faible.
Approche diagnostique des patients hémodynamiquement stables
Le diagnostic de l'EP repose sur les trois principes suivants: l'indice de suspicion, la probabilité pré-test et les résultats de tests subséquents.
L'évaluation de la probabilité clinique doit se faire avant toute chose. À cet effet, le Score de Wells est particulièrement utile.[46][47]
Plusieurs versions de ce score existent, mais la version modifiée est celle qui est privilégiée par les nouvelles lignes directrices. [48][6][49]Ainsi, à l'aide des points de la version originale, on obtient un risque clinique peu probable (0 à 4) ou un risque plus probable d'EP (> 4).
Une autre approche, soit les critères d'exclusion de l'EP (Pulmonary Embolism Rule-out Criterias ou PERC), a été développée pour les patients consultant aux urgences afin de sélectionner ceux chez qui la probabilité clinique d'EP est si faible que le bilan diagnostique ne devrait même pas être initié.[50] Pour les patients ayant une faible probabilité d'EP (score de Wells < 2) et remplissant les huit critères PERC, il est possible d'exclure le diagnostic d'EP.[1] Le PERC n'est valide que dans les milieux cliniques où la prévalence de l'EP est faible (< 15 %), ce qui est le cas pour la majorité des hôpitaux au Canada .[51][1] Voici la conduite à tenir en fonction de la probabilité d'EP : [1][6][48][52]
Notes importantes :
- Chez les patients atteints de cancer qui sont à faible probabilité d'avoir une EP selon le score de Wells, des niveaux normaux de D-dimères ne permettent pas d'exclure une TVP. Ainsi, il est possible de passer directement à l'imagerie chez cette population [6].
- Dans les cas ou l'angio-TDM et la scintigraphie V/Q ne seraient pas disponibles ou contre-indiquées, un doppler veineux des membres inférieurs et/ou supérieurs à la recherche d'un thrombus (la veine ne sera pas compressible) peut augmenter la suspicion clinique et confirmer le besoin de traiter un patient symptomatique. Cependant, une échographie négative ne permet pas d'exclure une EP.
Approche pour les patients hémodynamiquement instables
Pour les patients hémodynamiquement instables, chez qui l'obtention d'une imagerie pourrait être délétère, il peut être préférable d'utiliser l'échocardiographie au chevet ou l'échographie doppler des membres inférieurs pour obtenir un diagnostic présomptif d'EP afin de justifier l'administration de thérapies potentiellement vitales [6].
Score de Wells
| Critères | Points | Points (version simplifiée) |
Présent |
|---|---|---|---|
| Symptômes ou signes de thrombose veineuse profonde | 3 | 1 | |
| Autres diagnostics moins probables | 3 | 1 | |
| FC > 100/min | 1.5 | 1 | |
| Immobilisation (≥ 3 jours) ou chirurgie récente (< 4 semaines) | 1.5 | 1 | |
| Antécédents de thrombose veineuse profonde ou d'embolie pulmonaire | 1.5 | 1 | |
| Hémoptysies | 1 | 1 | |
| Cancer | 1 | 1 | |
| Probabilité | Faible | ||
| Probabilité (version simplifiée) | Peu probable | ||
- Version originale: faible (0-1), intermédiaire (2-6), Élevée (>6)[note 7]
- Version simplifiée: peu probable (0-1), plus probable (>1)[note 8]
Score PERC
| Critères |
|---|
| Âge < 50 ans |
| FC < 100/min |
| SatO2 ≥ 95 % |
| Absence d'hémoptysie |
| Absence d'utilisation d'oestrogènes |
| Absence de ATCD de TVP ou EP |
| Absence de gonflement unilatéral des jambes |
| Absence de chirurgie ou de traumatisme nécessitant une hospitalisation au cours des quatre semaines précédentes |
Interprétation : en présence des 8 critères, le patient a un risque < 1,6 % d'avoir une embolie pulmonaire. Selon le jugement clinique, l'embolie pulmonaire peut alors être exclue. À noter que le score n'a pas été étudié chez les femmes enceintes.
Algorithme diagnostique de YEARS
L'algorithme YEARS pour la prise en charge diagnostique simplifiée de l'EP est prometteuse, bien que les données soient limitées pour le moment. Cette approche repose sur trois critères, soit [54][55] :
- les signes cliniques de TVP (douleur à la palpation et œdème unilatéral)
- présence d'hémoptysie
- EP est le diagnostic le plus probable.
Cette approche a comme principal avantage de diminuer les examens d'imageries non requis. En effet, une réduction relative de 34 % d'utilisation d'angio-TDM pulmonaire a été observée dans l'étude PEGeD comparativement à l'approche standard qui ne se base que sur un seuil de D-Dimères de 500 ng/ml pour les patients à faible risque. Toutefois, aucune méta-analyse n'a validé cette approche pour le moment. [55]
Approche diagnostique chez les femmes enceintes
- Le test de D-dimères peut être utilisé en première ligne. Il est utile pour exclure l'EP si le niveau est < 500 ng/ml.
- Si les D-dimères sont > 500 ng/ml, l'échographie doppler des membres inférieurs sera effectuée à la recherche d'une TVP. La présence d'une TVP conduit à un diagnostic présomptif d'EP, alors qu'un résultat négatif n'exclut pas l'EP.
- Si l'échographie est négative, il faut procéder à un autre examen d'imagerie dont le choix est controversé : la scintigraphie V/Q amène une irradiation comportant un plus grand risque pour le fœtus, alors que l'angio-TDM amène une plus grande irradiation mammaire. Le choix de l'imagerie dépend du jugement clinique. [32]
Diagnostic
Le diagnostic d'une EP est établi à l'aide de la présentation clinique, des règles de décision cliniques, ainsi que des examens paracliniques individualisés au contexte du patient. Il est confirmé par l'imagerie.
Diagnostic différentiel
L'EP a une présentation clinique très hétérogène allant de la dyspnée à l'arrêt cardiaque soudain. Le diagnostic différentiel est donc étendu et comprend [1]:
- le syndrome coronarien aigu et l'ischémie cardiaque
- l'angine stable
- la péricardite aiguë
- l'insuffisance cardiaque congestive
- les arythmies
- la dissection aortique
- la pneumonie
- le pneumothorax
- la syncope vasovagale
- l'exacerbation aiguë de MPOC
- la crise d'anxiété avec hyperventilation (diagnostic d'exclusion)
Traitement
Le traitement de l'EP comporte quatre volets :
- le traitement de support
- les stratégies de reperfusion
- l'anticoagulothérapie
- le traitement de maintien et de suivi.
Celui-ci sera stratifié en fonction de l'impact hémodynamique de l'EP et en fonction de la suspicion d'EP chez un patient individuel. Les patients sont classés en suspicion d'EP faible, intermédiaire ou élevée sur la base du score Wells.
La décision d'hospitalisation repose sur les facteurs de mauvais pronostic présents (ou absents) chez le patient. Le score PESI permet de supporter le choix de l'orientation du patient : traitement ambulatoire ou hospitalisation.
Traitement de support
| Traitement de support | Explications |
|---|---|
| Hypoxémie |
|
| Hypotension |
|
| Analgésie |
|
| Trajectoire de soins |
|
Stratégies de reperfusion
Chez les patients avec une suspicion clinique élevée d'EP qui sont hémodynamiquement instables (signes vitaux affectés ou fonction du VD compromise) ou qui se détériorent cliniquement, la thrombolyse doit être considérée. Bien que controversées, l'embolectomie pulmonaire chirurgicale ou la thérapie dirigée par cathéter sont des options de reperfusion possibles chez des patients ciblés, dont ceux présentant des contre-indications à la thrombolyse.[1][56]
| Stratégie de reperfusion | Explications | ||||
|---|---|---|---|---|---|
| Thrombolyse |
| ||||
| Traitement dirigé par cathéter |
| ||||
| Embolectomie chirurgicale |
Anticoagulation
L'anticoagulation est le pilier du traitement de l'embolie pulmonaire. Chez ceux pour qui l'anticoagulation est contre-indiquée, l'installation percutanée d'un filtre dans la veine cave inférieure peut être envisagée une fois le diagnostic d'EP confirmé. Le traitement de l'EP se fait en deux phases, l'anticoagulation initiale et celle de maintien.
Anticoagulation initiale
| Hémodynamie | Suspicion | Description |
|---|---|---|
| Stable | Forte | Anticoagulation dès que possible |
| Moyenne | Attendre imagerie avant anticoagulation si peut être réalisée < 4 heures | |
| Faible | Attendre imagerie avant anticoagulation si peut être réalisée < 24 heures | |
| Instable et suspicion élevée | Traitement anticoagulant après thrombolyse[56] | |
Plusieurs choix d'anticoagulants sont possibles. Les lignes directrices favorisent généralement les anticoagulants oraux directs (inhibiteurs du facteur Xa PO) aux ponts à l'héparine avec la warfarine en traitement de maintien.
En règle général, l'héparine (peu importe sa forme) est préférée chez les patients à risque intermédiaire élevé et à haut risque (classification de l'ESC), puisqu'elle nous offre la possibilité de procéder à la thrombolyse plus rapidement advenant une détérioration clinique du patient.
L'héparine de bas poids moléculaire (HBPM), le fondaparinux et les inhibiteurs du facteur Xa sont préférés car :
- Ils ont une incidence moindre d'induction de saignements majeurs et de thrombocytopénie induite par l'héparine.
- Ils ont un profil d'utilisation prédictible et sécuritaire.
Toutefois, l'héparine non fractionnée (HNF) est à privilégier chez certains patients :
- Patient comportant un risque hémostatique élevé.
- Patient en post-thrombolyse, étant donné la possibilité de renverser rapidement l'action de HNF.
- Patient ayant une insuffisance rénale stade 3b-4 (DFG < 15-30 ml/min).
En effet, l'HPNF est préférée dans ces contextes en raison de sa faible demi-vie et de l'efficacité de l'antidote (protamine). En revanche, elle demande une hospitalisation et un suivi serré car son profil pharmacologique est difficilement prédictible.[67]
| Anticoagulant | Posologie |
|---|---|
| Héparine IV non fractionnée (HPNF) |
|
| Héparine de bas poids moléculaire SC (HBPM) |
|
| Inhibiteur du facteur Xa |
|
| Inhibiteur direct de la thrombine |
|
Anticoagulant de maintien
Le but de l'anticoagulation après la prise en charge aiguë de la PE est de compléter le traitement de l'épisode aigu et également de prévenir la récidive de la TEV sur le long terme.[1]
| Classe de médicament | Médicament | Commentaires |
|---|---|---|
| Anticoagulants oraux directs[69] |
|
|
| Antagoniste de la vitamine K PO | Warfarine à ajuster pour INR entre 2 et 3 | La warfarine demeure le premier choix chez certains patients [6][69]:
Chez la plupart des patients, son administration commencera en même temps que la thérapie initiale (souvent HBPM), car il faut compter un délai d'au moins cinq jours avant d'atteindre la fenêtre thérapeutique, c'est-à-dire un INR de 2 à 3 pendant deux jours consécutifs. Cependant, l'INR doit être dosé périodiquement afin d'empêcher l'anticoagulation excessive. |
| Héparine de bas poids moléculaire SC[note 12] |
|
|
Durée d'anticoagulation de maintien
La durée de l'anticoagulothérapie dépend principalement du contexte de l'embolie pulmonaire (provoquée vs non provoquée). Toute embolie pulmonaire doit être traitée au moins 3 mois, à moins de risques de saignement[note 11] surpassant les bénéfices.
Une embolie pulmonaire est considérée provoquée s'il y a eu :
- un trauma
- une chirurgie avec anesthésie générale d'une durée > 30 minutes
- une immbolisation dans un contexte aigu pour au moins 3 jours (typiquement hospitalisation d'au moins 3 jours)
- ou en fonction du jugement clinique.
Dans un tel contexte, advenant le 1er épisode, la durée d'anticoagulothérapie est de 3 mois inclusivement. Advenant des épisodes subséquents, la conduite demeure la même.
En présence d'un facteur de risque persistant (non-transitoire) ayant contribué de façon significative à l'embolie pulmonaire (alors dite provoquée), l'anticoagulothérapie doit être continuée jusqu'à la résolution du facteurs de risque en question. Cela inclut typiquement les néoplasies et les cathéters veineux.
Si l'embolie pulmonaire est dite non-provoquée, la pratique actuelle est d'anticoaguler pour un minimum de 3 mois et de ré-évaluer par la suite. Advenant plusieurs évènements thrombo-emboliques, la norme actuelle est d'anticoaguler à vie à moins d'un risque de saignement[note 11] dépassant les bénéfices de l'anticoagulation.
Le score HERDOO2 permet d'identifier, chez les femmes, un faible risque de récurrence de thromboembolie veineuse après un premier événement non-provoqué. Chez les femmes avec un score < 2, l'anticoagulation peut être cessée après 3 mois. L'anticoagulation devrait être poursuivie à plus long terme chez les femmes avec un score ≥ 2.[73]
| Facteur de risque | Points |
|---|---|
| Hyperpigmentation d'une jambe | 1 |
| Oedeme (Edema) d'une jambe | 1 |
| Rougeur d'une jambe | 1 |
| D-dimère ≥ 250 mcg/L | 1 |
| Obésité (IMC ≥ 30) | 1 |
| Âge (Older age) ≥ 65 ans | 1 |
| Score ≥ 2 = haut risque de récurence de thromboembolie si arrêt de l'anticoagulation. | |
Filtres de la veine cave inférieure
Ceux-ci bloquent le trajet des emboles en provenance de la circulation veineuse des membres inférieurs, empêchant ainsi l'atteinte de la vascularisation pulmonaire. Les indications sont :
- une contre-indication absolue aux anticoagulants
- une TEV récidivante malgré une anticoagulothérapie optimale.
Dès que possible, l'anticoagulothérapie doit être reprise et le filtre de la veine cave inférieur pourra éventuellement être retiré.
En effet, l'étude PREPIC (Prevention of Recurrent Pulmonary Embolism by Vena Cava Interruption) a montré que l'insertion d'un filtre permanent de la veine cave était associée à une réduction significative du risque de récidive d'EP et à une augmentation substantielle du risque de TVP, sans différence notable dans le risque de TEV récidivante ou de décès. [74][1][6]
Embolies sous-segmentaires
Les embolies sous-segmentaires font l'objet d'une controverse. En général, la présence d'au moins 2 embolies sous-segmentaires peuvent justifier, en absence de risque augmenté de saignement[note 11], une anticoagulothérapie telle que déjà discutée. Toutefois, en la présence d'une seule embolie pulmonaire sous-segmentaire et en l'absence d'une thrombose veineuse profonde, l'anticoagulothérapie n'est généralement pas de mise, sauf en présence d'un contexte prothrombotique concomitant tel que les néoplasies. [32][6][75][76][77]
Suivi
Les lignes directrices de l'ESC suggèrent un suivi de 3 à 6 mois.
Dans un contexte de dyspnée persistante, d'un fardeau embolique important et/ou de multiples épisodes thrombo-emboliques, il faut considérer l'évaluation de la pression pulmonaire avec une échographie transthoracique (ETT) de contrôle.
Si le patient est à haut risque d'une hypertension pulmonaire ou que l'ETT la démontre, il est recommandé d'effectuer une scintigraphie pulmonaire V/Q afin d'évaluer la possible présence d'une hypertension pulmonaire chronique de type IV (thrombo-embolique chronique). Si la scintigraphie se révèle anormale, le patient est normalement référé à un centre spécialisé pour l'hypertension pulmonaire.
Complications
Les complications majeures de l'EP peuvent être aiguës ou chroniques et elles comprennent [1]:
- le coeur pulmonaire aigu menant au choc cardiogénique et à la mort
- des récidives d'embolie pulmonaire à envisager s'il y a récurrence ou détérioration des symptômes[note 13]
- l'AVC[note 14][78] si embolies paradoxales par le passage au niveau d'un foramen oval patent
- le flutter auriculaire (chronique) et la fibrillation auriculaire (chronique)
- l'hypertension pulmonaire thromboembolique chronique (5 %) (HPTEC)[note 15].
Pour tous les patients atteints de HPTEC, un traitement anticoagulant à vie est recommandé. En outre, une référence précoce pour évaluer la possibilité d'une thromboendartériectomie pulmonaire est fortement recommandée. [1]
Évolution
L'évolution de la maladie est très variable étant donné sa grande hétérogénéité.
Il a été estimé que 10 % des victimes d'EP mourront dans les quelques heures suivant la venue des symptômes. L'embolie non traitée est associée à une mortalité cumulative (sur 5 ans) allant jusqu'à 30 %.
De nombreuses complications aiguës et chroniques sont possibles par la suite. Toutefois, un traitement anticoagulant oral prolongé réduit le risque de récidive de TEV d'environ 90 %, mais cet effet bénéfique s'accompagne d'un risque accru de saignement. Les anticoagulants oraux sont très efficaces pour prévenir les TEV récurrentes pendant la durée du traitement, mais ils n'éliminent pas le risque de récidive ultérieure lorsque le traitement est cessé.[79]
Les EP non provoquées sont associées à un risque de récidive de deux à trois fois plus élevé que les EP provoquées.[80] De plus, les patients présentant des facteurs de risque persistants ont un taux de récidive plus élevé que ceux présentant des facteurs de risque transitoires.[81]
Facteurs de mauvais pronostic
Le choc et le dysfonctionnement ventriculaire droit confèrent un mauvais pronostic et prédisent la mortalité chez les patients diagnostiqués avec l'EP.[82]Ceci peut être évalué cliniquement, radiologiquement ou encore à l'aide de marqueurs sériques [1]:
- Brain Natriuretic Peptide (BNP) : un peptide natriurétique de type B (BNP) élevé a une importance diagnostique limitée chez les patients soupçonnés d'avoir une EP.[83]Une surcharge de la pression du ventricule droit en raison d'une PE aiguë est associée à plus d'étirement myocardique, qui entraine la libération de peptide natriurétique de type B (BNP) et de N-terminal (NT) -proBNP. Ainsi, les niveaux de peptides natriurétiques dans le sang reflètent la sévérité du dysfonctionnement du RV dans la PE aiguë.[84][1]
- Troponine[1] : les taux sériques de troponine I et T sont bénéfiques pour le pronostic mais pas pour le diagnostic.
Les patients souffrant à la fois d'EP et de TVP présentent également un risque accru de décès.
Prédiction de la mortalité : score PESI
Plusieurs modèles pronostiques ont été conçus. L'indice de gravité de l'EP (PESI) et le PESI simplifié (sPESI) sont les plus couramment utilisés. Le score PESI prédit la mortalité à 30 jours chez les patients ayant un diagnostic établi de EP.[85]Le principal point fort du PESI et du sPESI réside dans l'identification des patients à faible risque de mortalité à 30 jours (PESI classes I et II). [1]
| Paramètre | Point [85] | Point (version simplifiée) [86] |
|---|---|---|
| Âge | + 1 par année | 1 si > 80 ans |
| Sexe masculin | 10 | - |
| Cancer | 30 | 1 |
| Insuffisance cardiaque chronique | 10 | 1 |
| Maladie pulmonaire chronique | 10 | 1 |
| Fréquence cardiaque ≥ 110 | 20 | 1 |
| TAS < 100 mm Hg | 30 | 1 |
| RR ≥ 30 rpm | 20 | - |
| Température < 36 ° C | 20 | - |
| Altération état mental (désorientation, léthargie, stupeur, coma) | 60 | - |
| SatO2 < 90 % | 20 | 1 |
Stratification des risques dans PESI [1]
- Classe I : points inférieurs ou égaux à 65; faible risque de mortalité à 30 jours de 1 à 6 %.
- Classe II : points 66 à 85; faible risque de mortalité de 1,7 à 3,5 %
- Classe III : points 86 à 105; risque de mortalité modéré de 3,2 à 7,1 %.
- Classe IV : points 106 à 125; risque de mortalité élevé de 4,0 à 11,4 %.
- Classe V : points plus de 125; risque de mortalité très élevé de 10,0 à 24,5 % .
Stratification des risques dans sPESI [1]
Si 0 point, risque de mortalité à 30 jours de 1,0 %
Si un ou plusieurs points, risque de mortalité à 30 jours de 10,9 %
Prévention
La meilleure prévention pour la thrombose veineuse profonde et l'EP est d'être conscient de ces pathologies. [87]
Certains scores, dont le score de Caprini, nous permettent d'évaluer le risque thromboembolique d'un patient et recommandent certaines interventions prophylactiques en fonction du niveau de risque. [88]
Plusieurs stratégies existent afin de prévenir les thromboembolies veineuses. [87] Elles visent les facteurs de risque mentionnés plus haut. Les principales stratégies sont les suivantes :
- Changements d'habitudes de vie dont la perte de poids, l'activité physique et l'arrêt tabagique. L'ambulation est particulièrement importante lors de longs voyages, par exemple un long trajet en avion.
- Les bas de compressions élastiques gradués et la compression pneumatique intermittente. Pour les patients à faible risque de TVP, les bas de compressions sont suffisants. Les bottes de compression pneumatique intermittente sont utilisés lorsque le patient est hospitalisé, car elles sont peu pratiques à la maison.
- Prophylaxie pharmacologique à l'aide de faibles doses d'HFPM ou d'HPNF.
- Filtres de la veine cave inférieure s'il y a une récurrence d'EP malgré l'utilisation d'anticoagulants à dose thérapeutique.
Notes
- ↑ Via un dommage de l'endothélium vasculaire
- ↑ Oedème, rougeur, douleur et veines superficielles collatérales au niveau du mollet ou de la cuisse
- ↑ Dans l'étude PIOPED 2, l'hyperthermie était signalée comme un signe potentiel, mais la fréquence chez les patients atteints d'embolie pulmonaire (2 %) était le même que chez les patients non atteints d'embolie pulmonaire (2 %). Conséquemment, il n'a pas été inclus ici, même si classiquement ce signe est enseigné.
- ↑ Diminution de la contractilité du mur libre du VD par rapport au sommet du VD
- ↑ Opacité peu profonde en forme de bosse. La base se trouve en périphérie du poumon, au niveau de la surface pleurale, alors que la bosse est vers le hile.
- ↑ C'est une coupure nette des vaisseaux pulmonaires avec hypoperfusion distale du poumon dans une distribution segmentaire. Cette constatation est le résultat d'une combinaison de la dilatation de l'artère pulmonaire proximale en raison du thrombus et de l'effondrement de la vascularisation distale.
- ↑ Pour le risque faible, on estime la probabilité à moins de 19%, pour le risque intermédiaire, il est entre 10% et 79% et pour le risque élevé, il est supérieur à 80%.
- ↑ 12% des cas d'EP seront décrits comme peu probables.
- ↑ Notons que plusieurs régimes existent dans la littérature, mais celui-ci est le plus simple.
- ↑ La dose de fondaparinux est de 50 % si la clairance de la créatinine est entre 30-50 ml/min; en dessous de 30 ml/min, elle est contre-indiquée.
- ↑ 11,0 11,1 11,2 et 11,3 Voici quelques facteurs de risque de saignement :
- âge > 65 ans
- antécédents de saignement
- thrombocytopénie
- thérapie anti-plaquettaire
- chutes fréquentes
- défaillance hépatique
- abus d'alcool
- chirurgie récente
- capacité fonctionnelle réduite
- antécédents d'AVC
- diabète
- anémie
- cancer
- insuffisance rénale
- ↑ Pour les patients à haut-risque souffrant de néoplasie ou ceux avec des EPs chroniques malgré l'usage d'autres anti-coagulants.
- ↑ Surtout une à deux semaines suivant le diagnostic initial. Une anticoagulation inadéquate est la raison la plus courante de récidive de la thromboembolie veineuse pendant le traitement.
- ↑ Il y aurait un risque accru d'accident vasculaire cérébral, que l'on pense être associé à une embolie paradoxale via un foramen ovale perméable (PFO) chez les patients atteints de EP aiguë.
- ↑ Se manifeste par la présence de dyspnée persistante ou progressive surtout dans les 3 mois à 2 ans suivant le diagnostic. Devrait être suivie avec un angio-TDM pulmonaire, une scintigraphie V/Q et une échocardiographie. Le diagnostic d'hypertension pulmonaire est confirmé par un cathétérisme cardiaque droit et une angiographie pulmonaire. Ces examens servent aussi à quantifier le degré d'hypertension pulmonaire, exclure les diagnostics concurrents, définir l'accessibilité chirurgicale des lésions thrombotiques obstructives, confirmer qu'une composante acceptable de la résistance vasculaire pulmonaire élevée est due à une maladie chirurgicalement accessible et non à une obstruction distale ou à une artériopathie secondaire.
Références
- Cette page a été modifiée ou créée le 2020/11/09 à partir de Acute Pulmonary Embolism (StatPearls / Acute Pulmonary Embolism (2020/08/10)), écrite par les contributeurs de StatPearls et partagée sous la licence CC-BY 4.0 international (jusqu'au 2022-12-08). Le contenu original est disponible à https://www.ncbi.nlm.nih.gov/pubmed/32809386 (livre).
- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 1,11 1,12 1,13 1,14 1,15 1,16 1,17 1,18 1,19 1,20 1,21 1,22 1,23 1,24 1,25 1,26 1,27 1,28 1,29 1,30 1,31 1,32 1,33 1,34 1,35 1,36 1,37 1,38 1,39 1,40 1,41 et 1,42 Vrinda Vyas et Amandeep Goyal, StatPearls, StatPearls Publishing, (PMID 32809386, lire en ligne)
- ↑ 2,0 et 2,1 (en) Aaron M. Wendelboe et Gary E. Raskob, « Global Burden of Thrombosis: Epidemiologic Aspects », Circulation Research, vol. 118, no 9, , p. 1340–1347 (ISSN 0009-7330 et 1524-4571, DOI 10.1161/CIRCRESAHA.115.306841, lire en ligne)
- ↑ G. E. Raskob, P. Angchaisuksiri, A. N. Blanco et H. Buller, « Thrombosis: a major contributor to global disease burden », Arteriosclerosis, Thrombosis, and Vascular Biology, vol. 34, no 11, , p. 2363–2371 (ISSN 1524-4636, PMID 25304324, DOI 10.1161/ATVBAHA.114.304488, lire en ligne)
- ↑ (en) Alexander T Cohen, Victor F Tapson, Jean-Francois Bergmann et Samuel Z Goldhaber, « Venous thromboembolism risk and prophylaxis in the acute hospital care setting (ENDORSE study): a multinational cross-sectional study », The Lancet, vol. 371, no 9610, , p. 387–394 (DOI 10.1016/S0140-6736(08)60202-0, lire en ligne)
- ↑ Kenneth T. Horlander, David M. Mannino et Kenneth V. Leeper, « Pulmonary embolism mortality in the United States, 1979-1998: an analysis using multiple-cause mortality data », Archives of Internal Medicine, vol. 163, no 14, , p. 1711–1717 (ISSN 0003-9926, PMID 12885687, DOI 10.1001/archinte.163.14.1711, lire en ligne)
- ↑ 6,00 6,01 6,02 6,03 6,04 6,05 6,06 6,07 6,08 6,09 6,10 6,11 6,12 6,13 6,14 et 6,15 (en) Marcello Di Nisio, Nick van Es et Harry R Büller, « Deep vein thrombosis and pulmonary embolism », The Lancet, vol. 388, no 10063, , p. 3060–3073 (DOI 10.1016/S0140-6736(16)30514-1, lire en ligne)
- ↑ (en) C. Kearon, W. Ageno, S. C. Cannegieter et B. Cosmi, « Categorization of patients as having provoked or unprovoked venous thromboembolism: guidance from the SSC of ISTH », Journal of Thrombosis and Haemostasis, vol. 14, no 7, , p. 1480–1483 (ISSN 1538-7836, DOI 10.1111/jth.13336, lire en ligne)
- ↑ W. W. Coon et P. W. Willis, « Deep venous thrombosis and pulmonary embolism: prediction, prevention and treatment », The American Journal of Cardiology, vol. 4, , p. 611–621 (ISSN 0002-9149, PMID 13811755, DOI 10.1016/0002-9149(59)90145-6, lire en ligne)
- ↑ 9,0 et 9,1 (en) Allan Victor Hoffbrand, Hoffbrand's Essential Haematology, , pages 303 à 307
- ↑ R. L. Kistner, J. J. Ball, R. A. Nordyke et G. C. Freeman, « Incidence of pulmonary embolism in the course of thrombophlebitis of the lower extremities », American Journal of Surgery, vol. 124, no 2, , p. 169–176 (ISSN 0002-9610, PMID 5045886, DOI 10.1016/0002-9610(72)90009-8, lire en ligne)
- ↑ K. M. Moser et J. R. LeMoine, « Is embolic risk conditioned by location of deep venous thrombosis? », Annals of Internal Medicine, vol. 94, no 4 pt 1, , p. 439–444 (ISSN 0003-4819, PMID 7212500, DOI 10.7326/0003-4819-94-4-439, lire en ligne)
- ↑ E. E. Weinmann et E. W. Salzman, « Deep-vein thrombosis », The New England Journal of Medicine, vol. 331, no 24, , p. 1630–1641 (ISSN 0028-4793, PMID 7772110, DOI 10.1056/NEJM199412153312407, lire en ligne)
- ↑ Kirsten van Langevelde, Alexandr Srámek, Patrice W. J. Vincken et Jan-Kees van Rooden, « Finding the origin of pulmonary emboli with a total-body magnetic resonance direct thrombus imaging technique », Haematologica, vol. 98, no 2, , p. 309–315 (ISSN 1592-8721, PMID 22801962, Central PMCID 3561441, DOI 10.3324/haematol.2012.069195, lire en ligne)
- ↑ P. D. Stein et J. W. Henry, « Clinical characteristics of patients with acute pulmonary embolism stratified according to their presenting syndromes », Chest, vol. 112, no 4, , p. 974–979 (ISSN 0012-3692, PMID 9377961, DOI 10.1378/chest.112.4.974, lire en ligne)
- ↑ G. Nakos, E. I. Kitsiouli et M. E. Lekka, « Bronchoalveolar lavage alterations in pulmonary embolism », American Journal of Respiratory and Critical Care Medicine, vol. 158, no 5 Pt 1, , p. 1504–1510 (ISSN 1073-449X, PMID 9817700, DOI 10.1164/ajrccm.158.5.9802036, lire en ligne)
- ↑ 16,0 16,1 et 16,2 (en) Robert Hillman, Hematology in Clinical Practice, , p. 428-431
- ↑ (en) G.E. Raskob, P. Angchaisuksiri, A.N. Blanco et H. Buller, « Thrombosis: A Major Contributor to Global Disease Burden », Arteriosclerosis, Thrombosis, and Vascular Biology, vol. 34, no 11, , p. 2363–2371 (ISSN 1079-5642 et 1524-4636, DOI 10.1161/ATVBAHA.114.304488, lire en ligne)
- ↑ Hilde Jensvoll, Marianne T. Severinsen, Jens Hammerstrøm et Sigrid K. Brækkan, « Existing data sources in clinical epidemiology: the Scandinavian Thrombosis and Cancer Cohort », Clinical Epidemiology, vol. 7, , p. 401–410 (ISSN 1179-1349, PMID 26396546, Central PMCID 4577261, DOI 10.2147/CLEP.S84279, lire en ligne)
- ↑ John A. Heit, « Epidemiology of venous thromboembolism », Nature Reviews. Cardiology, vol. 12, no 8, , p. 464–474 (ISSN 1759-5010, PMID 26076949, Central PMCID 4624298, DOI 10.1038/nrcardio.2015.83, lire en ligne)
- ↑ (en) Paul D. Stein, Michael L. Terrin, Charles A. Hales et Harold I. Palevsky, « Clinical, Laboratory, Roentgenographic, and Electrocardiographic Findings in Patients with Acute Pulmonary Embolism and No Pre-Existing Cardiac or Pulmonary Disease », Chest, vol. 100, no 3, 1991-09-xx, p. 598–603 (DOI 10.1378/chest.100.3.598, lire en ligne)
- ↑ 21,0 et 21,1 (en) Paul D. Stein, Afzal Beemath, Fadi Matta et John G. Weg, « Clinical Characteristics of Patients with Acute Pulmonary Embolism: Data from PIOPED II », The American Journal of Medicine, vol. 120, no 10, 2007-10-xx, p. 871–879 (PMID 17904458, Central PMCID PMC2071924, DOI 10.1016/j.amjmed.2007.03.024, lire en ligne)
- ↑ P. Girard, M. Decousus, S. Laporte et A. Buchmuller, « Diagnosis of pulmonary embolism in patients with proximal deep vein thrombosis: specificity of symptoms and perfusion defects at baseline and during anticoagulant therapy », American Journal of Respiratory and Critical Care Medicine, vol. 164, no 6, , p. 1033–1037 (ISSN 1073-449X, PMID 11587992, DOI 10.1164/ajrccm.164.6.2101045, lire en ligne)
- ↑ M. Rodger, D. Makropoulos, M. Turek et J. Quevillon, « Diagnostic value of the electrocardiogram in suspected pulmonary embolism », The American Journal of Cardiology, vol. 86, no 7, , p. 807–809, A10 (ISSN 0002-9149, PMID 11018210, DOI 10.1016/s0002-9149(00)01090-0, lire en ligne)
- ↑ D. F. Worsley, A. Alavi, J. M. Aronchick et J. T. Chen, « Chest radiographic findings in patients with acute pulmonary embolism: observations from the PIOPED Study », Radiology, vol. 189, no 1, , p. 133–136 (ISSN 0033-8419, PMID 8372182, DOI 10.1148/radiology.189.1.8372182, lire en ligne)
- ↑ (en) R. E. G. Schutgens, F. J. L. M. Haas, W. B. M. Gerritsen et F. Van Der Horst, « The usefulness of five d-dimer assays in the exclusion of deep venous thrombosis », Journal of Thrombosis and Haemostasis, vol. 1, no 5, , p. 976–981 (ISSN 1538-7836, DOI 10.1046/j.1538-7836.2003.00148.x, lire en ligne)
- ↑ 26,0 26,1 et 26,2 Marc Righini, Josien Van Es, Paul L. Den Exter et Pierre-Marie Roy, « Age-adjusted D-dimer cutoff levels to rule out pulmonary embolism: the ADJUST-PE study », JAMA, vol. 311, no 11, , p. 1117–1124 (ISSN 1538-3598, PMID 24643601, DOI 10.1001/jama.2014.2135, lire en ligne)
- ↑ 27,0 et 27,1 (en) H. J. Schouten, G. J. Geersing, H. L. Koek et N. P. A. Zuithoff, « Diagnostic accuracy of conventional or age adjusted D-dimer cut-off values in older patients with suspected venous thromboembolism: systematic review and meta-analysis », BMJ, vol. 346, no may03 1, , f2492–f2492 (ISSN 1756-1833, PMID 23645857, Central PMCID PMC3643284, DOI 10.1136/bmj.f2492, lire en ligne)
- ↑ 10.1056/NEJMoa052367
- ↑ 10.1056/NEJMoa052367
- ↑ 10.1056/NEJMoa052367
- ↑ 10.1056/NEJMoa052367
- ↑ 32,0 32,1 et 32,2 Opinion d'expert (Helman, A, Lang, E, DeWit, K) [août 2018 (production)] Entendu lors d'un podcast emergency medicine cases. Disponible : https://emergencymedicinecases.com/pulmonary-embolism-diagnosis-2-imaging-pregnancy-subsegmental-pe/
- ↑ M. W. Wolfe, R. T. Lee, M. L. Feldstein et J. A. Parker, « Prognostic significance of right ventricular hypokinesis and perfusion lung scan defects in pulmonary embolism », American Heart Journal, vol. 127, no 5, , p. 1371–1375 (ISSN 0002-8703, PMID 8172067, DOI 10.1016/0002-8703(94)90058-2, lire en ligne)
- ↑ S. Grifoni, I. Olivotto, P. Cecchini et F. Pieralli, « Short-term clinical outcome of patients with acute pulmonary embolism, normal blood pressure, and echocardiographic right ventricular dysfunction », Circulation, vol. 101, no 24, , p. 2817–2822 (ISSN 1524-4539, PMID 10859287, DOI 10.1161/01.cir.101.24.2817, lire en ligne)
- ↑ A. Torbicki, M. Kurzyna, M. Ciurzynski et P. Pruszczyk, « Proximal pulmonary emboli modify right ventricular ejection pattern », The European Respiratory Journal, vol. 13, no 3, , p. 616–621 (ISSN 0903-1936, PMID 10232436, DOI 10.1183/09031936.99.13361699, lire en ligne)
- ↑ Carlo Bova, Francesco Greco, Gianfranco Misuraca et Oscar Serafini, « Diagnostic utility of echocardiography in patients with suspected pulmonary embolism », The American Journal of Emergency Medicine, vol. 21, no 3, , p. 180–183 (ISSN 0735-6757, PMID 12811708, DOI 10.1016/s0735-6757(02)42257-7, lire en ligne)
- ↑ Marcin Kurzyna, Adam Torbicki, Piotr Pruszczyk et Barbara Burakowska, « Disturbed right ventricular ejection pattern as a new Doppler echocardiographic sign of acute pulmonary embolism », The American Journal of Cardiology, vol. 90, no 5, , p. 507–511 (ISSN 0002-9149, PMID 12208411, DOI 10.1016/s0002-9149(02)02523-7, lire en ligne)
- ↑ 38,0 et 38,1 Piotr Pruszczyk, Sylwia Goliszek, Barbara Lichodziejewska et Maciej Kostrubiec, « Prognostic value of echocardiography in normotensive patients with acute pulmonary embolism », JACC. Cardiovascular imaging, vol. 7, no 6, , p. 553–560 (ISSN 1876-7591, PMID 24412192, DOI 10.1016/j.jcmg.2013.11.004, lire en ligne)
- ↑ Robert-Ebadi, Helia. Glauser, Frédéric, médecin. Manzocchi, Sara. Blondon, Marc. Mahhou-Sennouni, Fatima. Righini, Marc., Evolution des techniques d'imagerie dans le diagnostic de l'embolie pulmonaire (OCLC 994739939, lire en ligne)
- ↑ R. D. Hull, J. Hirsh, C. J. Carter et R. M. Jay, « Pulmonary angiography, ventilation lung scanning, and venography for clinically suspected pulmonary embolism with abnormal perfusion lung scan », Annals of Internal Medicine, vol. 98, no 6, , p. 891–899 (ISSN 0003-4819, PMID 6859705, DOI 10.7326/0003-4819-98-6-891, lire en ligne)
- ↑ Grégoire Le Gal, Marc Righini, Oliver Sanchez et Pierre-Marie Roy, « A positive compression ultrasonography of the lower limb veins is highly predictive of pulmonary embolism on computed tomography in suspected patients », Thrombosis and Haemostasis, vol. 95, no 6, , p. 963–966 (ISSN 0340-6245, PMID 16732375, DOI 10.1160/TH06-03-0158, lire en ligne)
- ↑ A. B. van Rossum, H. C. van Houwelingen, G. J. Kieft et P. M. Pattynama, « Prevalence of deep vein thrombosis in suspected and proven pulmonary embolism: a meta-analysis », The British Journal of Radiology, vol. 71, no 852, , p. 1260–1265 (ISSN 0007-1285, PMID 10318998, DOI 10.1259/bjr.71.852.10318998, lire en ligne)
- ↑ 43,0 et 43,1 (en) Ying Kan, Leilei Yuan, Jacqui K Meeks et Chunlin Li, « The accuracy of V/Q SPECT in the diagnosis of pulmonary embolism: a meta-analysis », Acta Radiologica, vol. 56, no 5, , p. 565–572 (ISSN 0284-1851 et 1600-0455, DOI 10.1177/0284185114533682, lire en ligne)
- ↑ 44,0 et 44,1 (en) P. D. Stein, L. M. Freeman, H. D. Sostman et L. R. Goodman, « SPECT in Acute Pulmonary Embolism », Journal of Nuclear Medicine, vol. 50, no 12, , p. 1999–2007 (ISSN 0161-5505, DOI 10.2967/jnumed.109.063958, lire en ligne)
- ↑ (en) Stavros V Konstantinides, « 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS): The Task Force for the diagnosis and management of acute pulmonary embolism of the European Society of Cardiology (ESC) », European Heart Journal, , Pages 543–603 (lire en ligne)
- ↑ Philip S. Wells, David R. Anderson, Marc Rodger et Melissa Forgie, « Evaluation of D-dimer in the diagnosis of suspected deep-vein thrombosis », The New England Journal of Medicine, vol. 349, no 13, , p. 1227–1235 (ISSN 1533-4406, PMID 14507948, DOI 10.1056/NEJMoa023153, lire en ligne)
- ↑ P. S. Wells, D. R. Anderson, M. Rodger et J. S. Ginsberg, « Derivation of a simple clinical model to categorize patients probability of pulmonary embolism: increasing the models utility with the SimpliRED D-dimer », Thrombosis and Haemostasis, vol. 83, no 3, , p. 416–420 (ISSN 0340-6245, PMID 10744147, lire en ligne)
- ↑ 48,0 et 48,1 « Venous thromboembolic diseases: diagnosis, management and thrombophilia testing », sur nice.org.uk, (consulté le 17 janvier 2021)
- ↑ « Effectiveness of Managing Suspected Pulmonary Embolism Using an Algorithm Combining Clinical Probability, D-Dimer Testing, and Computed Tomography », JAMA, vol. 295, no 2, , p. 172 (ISSN 0098-7484, DOI 10.1001/jama.295.2.172, lire en ligne)
- ↑ 50,0 et 50,1 J. A. Kline, A. M. Mitchell, C. Kabrhel et P. B. Richman, « Clinical criteria to prevent unnecessary diagnostic testing in emergency department patients with suspected pulmonary embolism », Journal of thrombosis and haemostasis: JTH, vol. 2, no 8, , p. 1247–1255 (ISSN 1538-7933, PMID 15304025, DOI 10.1111/j.1538-7836.2004.00790.x, lire en ligne)
- ↑ O. Hugli, M. Righini, G. Le Gal et P.-M. Roy, « The pulmonary embolism rule-out criteria (PERC) rule does not safely exclude pulmonary embolism », Journal of thrombosis and haemostasis: JTH, vol. 9, no 2, , p. 300–304 (ISSN 1538-7836, PMID 21091866, DOI 10.1111/j.1538-7836.2010.04147.x, lire en ligne)
- ↑ Paul D. Stein, Sarah E. Fowler, Lawrence R. Goodman et Alexander Gottschalk, « Multidetector computed tomography for acute pulmonary embolism », The New England Journal of Medicine, vol. 354, no 22, , p. 2317–2327 (ISSN 1533-4406, PMID 16738268, DOI 10.1056/NEJMoa052367, lire en ligne)
- ↑ P. S. Wells, D. R. Anderson, M. Rodger et I. Stiell, « Excluding pulmonary embolism at the bedside without diagnostic imaging: management of patients with suspected pulmonary embolism presenting to the emergency department by using a simple clinical model and d-dimer », Annals of Internal Medicine, vol. 135, no 2, , p. 98–107 (ISSN 0003-4819, PMID 11453709, lire en ligne)
- ↑ (en) Tom van der Hulle, Whitney Y Cheung, Stephanie Kooij et Ludo F M Beenen, « Simplified diagnostic management of suspected pulmonary embolism (the YEARS study): a prospective, multicentre, cohort study », The Lancet, vol. 390, no 10091, , p. 289–297 (DOI 10.1016/S0140-6736(17)30885-1, lire en ligne)
- ↑ 55,0 et 55,1 (en) Clive Kearon, Kerstin de Wit, Sameer Parpia et Sam Schulman, « Diagnosis of Pulmonary Embolism with d -Dimer Adjusted to Clinical Probability », New England Journal of Medicine, vol. 381, no 22, , p. 2125–2134 (ISSN 0028-4793 et 1533-4406, DOI 10.1056/NEJMoa1909159, lire en ligne)
- ↑ 56,0 et 56,1 (en) « PULMONARY EMBOLISM: DIAGNOSIS AND MANAGEMENT », sur thrombosiscanada.ca, (consulté le 17 janvier 2021)
- ↑ S. Z. Goldhaber, W. D. Haire, M. L. Feldstein et M. Miller, « Alteplase versus heparin in acute pulmonary embolism: randomised trial assessing right-ventricular function and pulmonary perfusion », Lancet (London, England), vol. 341, no 8844, , p. 507–511 (ISSN 0140-6736, PMID 8094768, DOI 10.1016/0140-6736(93)90274-k, lire en ligne)
- ↑ S. Dalla-Volta, A. Palla, A. Santolicandro et C. Giuntini, « PAIMS 2: alteplase combined with heparin versus heparin in the treatment of acute pulmonary embolism. Plasminogen activator Italian multicenter study 2 », Journal of the American College of Cardiology, vol. 20, no 3, , p. 520–526 (ISSN 0735-1097, PMID 1512328, DOI 10.1016/0735-1097(92)90002-5, lire en ligne)
- ↑ L. B. Daniels, J. A. Parker, S. R. Patel et F. Grodstein, « Relation of duration of symptoms with response to thrombolytic therapy in pulmonary embolism », The American Journal of Cardiology, vol. 80, no 2, , p. 184–188 (ISSN 0002-9149, PMID 9230156, DOI 10.1016/s0002-9149(97)00315-9, lire en ligne)
- ↑ Christophe Marti, Gregor John, Stavros Konstantinides et Christophe Combescure, « Systemic thrombolytic therapy for acute pulmonary embolism: a systematic review and meta-analysis », European Heart Journal, vol. 36, no 10, , p. 605–614 (ISSN 1522-9645, PMID 24917641, Central PMCID 4352209, DOI 10.1093/eurheartj/ehu218, lire en ligne)
- ↑ (en) Jennifer E. Fugate et Alejandro A. Rabinstein, « Absolute and Relative Contraindications to IV rt-PA for Acute Ischemic Stroke: », The Neurohospitalist, (PMID 26288669, Central PMCID PMC4530420, DOI 10.1177/1941874415578532, lire en ligne)
- ↑ Alfonso J. Tafur, Fadi E. Shamoun, Salma I. Patel et Denisse Tafur, « Catheter-Directed Treatment of Pulmonary Embolism: A Systematic Review and Meta-Analysis of Modern Literature », Clinical and Applied Thrombosis/Hemostasis: Official Journal of the International Academy of Clinical and Applied Thrombosis/Hemostasis, vol. 23, no 7, , p. 821–829 (ISSN 1938-2723, PMID 27481877, DOI 10.1177/1076029616661414, lire en ligne)
- ↑
- ↑ Timothy Lee, Shinobu Itagaki, Yuting P. Chiang et Natalia N. Egorova, « Survival and recurrence after acute pulmonary embolism treated with pulmonary embolectomy or thrombolysis in New York State, 1999 to 2013 », The Journal of Thoracic and Cardiovascular Surgery, vol. 155, no 3, , p. 1084–1090.e12 (ISSN 1097-685X, PMID 28942971, DOI 10.1016/j.jtcvs.2017.07.074, lire en ligne)
- ↑ W. Brent Keeling, Thor Sundt, Marzia Leacche et Yutaka Okita, « Outcomes After Surgical Pulmonary Embolectomy for Acute Pulmonary Embolus: A Multi-Institutional Study », The Annals of Thoracic Surgery, vol. 102, no 5, , p. 1498–1502 (ISSN 1552-6259, PMID 27373187, DOI 10.1016/j.athoracsur.2016.05.004, lire en ligne)
- ↑ Chetan Pasrija, Anthony Kronfli, Michael Rouse et Maxwell Raithel, « Outcomes after surgical pulmonary embolectomy for acute submassive and massive pulmonary embolism: A single-center experience », The Journal of Thoracic and Cardiovascular Surgery, vol. 155, no 3, , p. 1095–1106.e2 (ISSN 1097-685X, PMID 29452460, DOI 10.1016/j.jtcvs.2017.10.139, lire en ligne)
- ↑ https://www.ncbi.nlm.nih.gov/pubmed/32809386
- ↑ (en) « Unfractionned heparin, low molecular weight heparin and fondaparinux », sur thrombosiscanada.ca, (consulté le 8 octobre 2021)
- ↑ 69,0 69,1 et 69,2 « Thrombose veineuse profonde et embolie pulmonaire chez l'adulte », sur Inesss.qc.ca, (consulté le 6 septembre 2021)
- ↑ (en) Giancarlo Agnelli, Harry R. Buller, Alexander Cohen et Madelyn Curto, « Apixaban for Extended Treatment of Venous Thromboembolism », New England Journal of Medicine, vol. 368, no 8, , p. 699–708 (ISSN 0028-4793 et 1533-4406, DOI 10.1056/NEJMoa1207541, lire en ligne)
- ↑ (en) Jeffrey I. Weitz, Anthonie W.A. Lensing, Martin H. Prins et Rupert Bauersachs, « Rivaroxaban or Aspirin for Extended Treatment of Venous Thromboembolism », New England Journal of Medicine, vol. 376, no 13, , p. 1211–1222 (ISSN 0028-4793 et 1533-4406, DOI 10.1056/NEJMoa1700518, lire en ligne)
- ↑ (en) Clive Kearon, Elie A. Akl, Joseph Ornelas et Allen Blaivas, « Antithrombotic Therapy for VTE Disease », Chest, vol. 149, no 2, , p. 315–352 (DOI 10.1016/j.chest.2015.11.026, lire en ligne)
- ↑ 73,0 et 73,1 (en) Marc A. Rodger, Gregoire Le Gal, David R. Anderson et Jeannot Schmidt, « Validating the HERDOO2 rule to guide treatment duration for women with unprovoked venous thrombosis: multinational prospective cohort management study », BMJ, vol. 356, , j1065 (ISSN 0959-8138 et 1756-1833, PMID 28314711, Central PMCID PMC6287588, DOI 10.1136/bmj.j1065, lire en ligne)
- ↑ PREPIC Study Group, « Eight-year follow-up of patients with permanent vena cava filters in the prevention of pulmonary embolism: the PREPIC (Prevention du Risque d'Embolie Pulmonaire par Interruption Cave) randomized study », Circulation, vol. 112, no 3, , p. 416–422 (ISSN 1524-4539, PMID 16009794, DOI 10.1161/CIRCULATIONAHA.104.512834, lire en ligne)
- ↑ Hugo HB Yoo, Vania Santos Nunes-Nogueira et Paulo J Fortes Villas Boas, « Anticoagulant treatment for subsegmental pulmonary embolism », Cochrane Database of Systematic Reviews, (ISSN 1465-1858, PMID 32030721, Central PMCID PMC7004894, DOI 10.1002/14651858.cd010222.pub4, lire en ligne)
- ↑ (en) Hugo HB Yoo, Thais HAT Queluz et Regina El Dib, Cochrane Database of Systematic Reviews, John Wiley & Sons, Ltd, (DOI 10.1002/14651858.cd010222.pub2, lire en ligne), p. CD010222.pub2
- ↑ (en) J. Goy, J. Lee, O. Levine et S. Chaudhry, « Sub-segmental pulmonary embolism in three academic teaching hospitals: a review of management and outcomes », Journal of Thrombosis and Haemostasis, vol. 13, no 2, , p. 214–218 (DOI 10.1111/jth.12803, lire en ligne)
- ↑ Sylwia Goliszek, Małgorzata Wiśniewska, Katarzyna Kurnicka et Barbara Lichodziejewska, « Patent foramen ovale increases the risk of acute ischemic stroke in patients with acute pulmonary embolism leading to right ventricular dysfunction », Thrombosis Research, vol. 134, no 5, , p. 1052–1056 (ISSN 1879-2472, PMID 25282541, DOI 10.1016/j.thromres.2014.09.013, lire en ligne)
- ↑ Giancarlo Agnelli, Paolo Prandoni, Cecilia Becattini et Mauro Silingardi, « Extended oral anticoagulant therapy after a first episode of pulmonary embolism », Annals of Internal Medicine, vol. 139, no 1, , p. 19–25 (ISSN 1539-3704, PMID 12834314, DOI 10.7326/0003-4819-139-1-200307010-00008, lire en ligne)
- ↑ Florent Boutitie, Laurent Pinede, Sam Schulman et Giancarlo Agnelli, « Influence of preceding length of anticoagulant treatment and initial presentation of venous thromboembolism on risk of recurrence after stopping treatment: analysis of individual participants' data from seven trials », BMJ (Clinical research ed.), vol. 342, , d3036 (ISSN 1756-1833, PMID 21610040, Central PMCID 3100759, DOI 10.1136/bmj.d3036, lire en ligne)
- ↑ Daniela Poli et Massimo Miniati, « The incidence of recurrent venous thromboembolism and chronic thromboembolic pulmonary hypertension following a first episode of pulmonary embolism », Current Opinion in Pulmonary Medicine, vol. 17, no 5, , p. 392–397 (ISSN 1531-6971, PMID 21743331, DOI 10.1097/MCP.0b013e328349289a, lire en ligne)
- ↑ Guillaume Coutance, Emmanuelle Cauderlier, Javed Ehtisham et Michèle Hamon, « The prognostic value of markers of right ventricular dysfunction in pulmonary embolism: a meta-analysis », Critical Care (London, England), vol. 15, no 2, , R103 (ISSN 1466-609X, PMID 21443777, Central PMCID 3219376, DOI 10.1186/cc10119, lire en ligne)
- ↑ David G. Kiely, Norman S. Kennedy, Omar Pirzada et Sheila A. Batchelor, « Elevated levels of natriuretic peptides in patients with pulmonary thromboembolism », Respiratory Medicine, vol. 99, no 10, , p. 1286–1291 (ISSN 0954-6111, PMID 16099151, DOI 10.1016/j.rmed.2005.02.029, lire en ligne)
- ↑ T. Henzler, S. Roeger, M. Meyer et U. J. Schoepf, « Pulmonary embolism: CT signs and cardiac biomarkers for predicting right ventricular dysfunction », The European Respiratory Journal, vol. 39, no 4, , p. 919–926 (ISSN 1399-3003, PMID 21965223, DOI 10.1183/09031936.00088711, lire en ligne)
- ↑ 85,0 85,1 et 85,2 Drahomir Aujesky, D. Scott Obrosky, Roslyn A. Stone et Thomas E. Auble, « Derivation and validation of a prognostic model for pulmonary embolism », American Journal of Respiratory and Critical Care Medicine, vol. 172, no 8, , p. 1041–1046 (ISSN 1073-449X, PMID 16020800, Central PMCID 2718410, DOI 10.1164/rccm.200506-862OC, lire en ligne)
- ↑ 86,0 et 86,1 David Jiménez, Drahomir Aujesky, Lisa Moores et Vicente Gómez, « Simplification of the pulmonary embolism severity index for prognostication in patients with acute symptomatic pulmonary embolism », Archives of Internal Medicine, vol. 170, no 15, , p. 1383–1389 (ISSN 1538-3679, PMID 20696966, DOI 10.1001/archinternmed.2010.199, lire en ligne)
- ↑ 87,0 et 87,1 (en) Samuel Z. Goldhaber et John Fanikos, « Prevention of Deep Vein Thrombosis and Pulmonary Embolism », Circulation, vol. 110, no 16, (ISSN 0009-7322 et 1524-4539, DOI 10.1161/01.CIR.0000145141.70264.C5, lire en ligne)
- ↑ K. V. Lobastov, V. E. Barinov, I. V. Schastlivtsev et L. A. Laberko, « [Caprini score as individual risk assessment model of postoperative venous thromboembolism in patients with high surgical risk] », Khirurgiia, no 12, , p. 16–23 (ISSN 0023-1207, PMID 25589313, lire en ligne)

