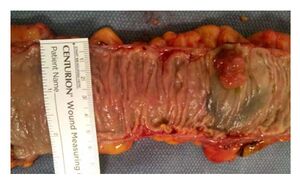
Cancer du côlon
Le cancer du côlon est une maladie dans laquelle des cellules malignes (cancéreuses) se forment dans les tissus muqueux du côlon.
Épidémiologie
Les taux d'incidence et de mortalité du cancer colorectal varient considérablement dans le monde[1]. D'après la base de données GLOBOCAN de l'Organisation mondiale de la santé, le cancer colorectal est le troisième cancer le plus fréquemment diagnostiqué chez les hommes et le deuxième chez les femmes[2]. Il s'agit du troisième diagnostic le plus fréquent et la deuxième tumeur maligne la plus meurtrière pour les deux sexes confondus. Les taux d'incidence et de mortalité sont considérablement plus élevés chez les hommes que chez les femmes. Les taux d'incidence les plus élevés sont enregistrés en Australie, en Nouvelle-Zélande, en Europe et en Amérique du Nord, tandis que les taux les plus faibles sont observés en Afrique et en Asie centrale et du Sud[3]. Ces différences géographiques semblent être attribuables à des différences dans les expositions alimentaires et environnementales qui sont imposées sur un fond de susceptibilité génétiquement déterminée. Au Canada, la Société canadienne du cancer estime qu'en 2020, 26 900 Canadiens recevront un diagnostic de cancer colorectal, ce qui représente 12 % de tous les nouveaux cas de cancer en 2020. De ce nombre, 9 700 Canadiens mourront, ce qui représente 12 % de tous les décès par cancer en 2020.[4]
Un faible statut socio-économique semble également associé à un risque accru de développer un cancer colorectal; une étude a estimé que le risque de cancer colorectal était environ 30 % plus élevé dans le quintile de statut socio-économique le plus bas que dans le quintile le plus élevé[5]. On pense que des comportements potentiellement modifiables, tels que l'inactivité physique, une alimentation malsaine, le tabagisme et l'obésité, sont à l'origine d'une proportion substantielle (estimée entre un tiers et la moitié) de la disparité socio-économique du risque de nouveaux cas de CCR [5][6]. D'autres facteurs, en particulier les taux plus faibles de dépistage du cancer colorectal, contribuent également de manière substantielle aux différences de risque de cancer colorectal liées au statut socio-économique [7].
Étiologies
Le cancer du côlon peut se présenter de manière :
- sporadique (70 %)
- familiale (20 %)
- héréditaire (5-10 %)[8] :
- le syndrome de Lynch (cancer colorectal héréditaire sans polypose [HNPCC])
- la polypose adénomateuse familiale.
L'âge moyen du diagnostic pour les cas sporadiques est supérieur à 50 ans et est principalement lié à des facteurs environnementaux, contrairement à une minorité de patients présentant un véritable modèle héréditaire qui comporte un risque plus élevé à un âge plus jeune (moins de 50 ans).
Physiopathologie
La transformation de l'épithélium colique normal en lésion précancéreuse (adénome) et finalement en carcinome invasif nécessite une accumulation de mutations génétiques somatiques (acquises) et/ou germinales (héréditaires). La théorie de la cancérogenèse colique met en évidence une évolution clonale des mutations qui confèrent à la cellule un avantage en termes de survie et d'immortalité tout en lui permettant de développer d'autres mutations qui sont à l'origine d'autres caractéristiques cancéreuses comme la prolifération, l'invasion et les métastases[9][10]. Les cancers colorectaux proviennent souvent de polypes adénomateux qui acquièrent généralement des modifications dysplasiques sur une période de 10 à 15 ans avant de développer un carcinome invasif : la détection et l'élimination précoces des polypes réduisent l'incidence de ces cancers. Les polypes hamartomateux et festonnés pouvaient également conduire au cancer colorectal par une séquence de mutations différentes de la cascade classique des polypes adénomateux tubulaires ou villeux.
Il existe trois grandes voies moléculaires liées au cancer colorectal :
- La voie de l'instabilité chromosomique est un gain de mutations qui perturbe l'équilibre entre les oncogènes et les suppresseurs de tumeurs, comme on le voit avec les mutations de l'adenomatosus polyposis coli (APC) dans les cas de la polypose adénomateuse familiale.
- Les cellules qui présentent une déficience de la réparation des mésappariements de l'ADN (dMMR) accumulent des erreurs dans le génome qui se répètent, provoquant des niveaux élevés d'instabilité des microsatellites (MSI-H), comme dans le syndrome de Lynch.
- L'hyperméthylation de l'ADN pourrait activer ou réduire au silence l'expression de certains gènes, respectivement BRAF et MLH1.
Des mutations somatiques sporadiques d'oncogènes (RAS, SRC, MYC) ont été impliquées dans le cancer colorectal, la mutation RAS présentant la plus grande importance clinique. Des variantes de mutations RAS (HRAS, KRAS, NRAS) sont trouvées dans 50 % des cas sporadiques de cancer colorectal, actuellement exploitées pour le dépistage du cancer par test d'ADN dans les selles.
D'autre part, les gènes suppresseurs de tumeurs nécessitent une perte bi-allélique (modèle à deux coups) et sont décrits dans la perte du gène APC 5q21 (80 % de cas sporadiques), du gène TP53 17p (50-70 % de cas sporadiques) et du gène DCC/SMAD2-4 18q (73 % de cas sporadiques). Des mutations spécifiques du gène MMR peuvent se produire dans les gènes hMSH2, hMLH1, hPMS1 et hPMS2, hMSH6 et hMLH3; chacun d'entre eux interagit avec MLH1 et se retrouve approximativement dans 15 % de tous les cas de cancers colorectaux sporadiques, provoquant un syndrome de type Lynch avec MSI-H qui appelle à un dépistage universel. Les défauts de MUTYH ont un modèle d'héritage récessif à un moment nécessitant un deuxième coup bi-allélique ou en conjonction avec la mutation du gène APC. Les gènes de la cyclo-oxygénase (COX-2) et du récepteur activateur de la prolifération des peroxysomes (PPAR) ont été impliqués dans la tumorigenèse du cancer colorectal et font actuellement l'objet de recherches sur la chimioprotection.
Présentation clinique
Facteurs de risque
Les principaux facteurs de risque du cancer du côlon sont[11][12] :
- le sexe masculin
- des antécédents familiaux de cancer colorectal
- des antécédents personnels de cancer colorectal
- des troubles génétiques rares[13] :
- l'embonpoint ou l'obésité[14][15]
- la consommation d'alcool
- le tabagisme
- l'alimentation riche en viande rouge, en viandes transformées[16] et la cuisson des viandes à température élevée
- l'alimentation faible en fibres
- la sédentarité
- le diabète sucré[17]
- l'exposition aux rayonnements ionisants (radiothérapie)[18]
- être de descendance juive ashkénaze
- des antécédents personnels de cancer du sein, de l'ovaire ou de l'utérus
- une grande taille à l'âge adulte
- présence de polype colique ou rectal
- les maladies inflammatoires intestinales (colite ulcéreuse et maladie de Crohn)[note 1][1]
- l'immunosuppression à long terme.
Une anamnèse familiale complète est d'une grande pertinence pour identifier les groupes familiaux et les schémas inhérents qui modifieraient la surveillance et le traitement du patient à haut risque.
Questionnaire
Les symptômes d'un cancer colorectal sont :
- les rectorragies (souvent le sang est mêlé à la selle)
- une diminution du calibre des selles
- des douleurs abdominales
- une perte de poids, un perte d'appétit et de la fatigue
- une lésion anale.
Dans les stades précoces de la maladie, le cancer du côlon peut être totalement asymptomatique.
Parfois, on découvre le cancer du côlon dans le contexte d'une complication de la maladie :
- l'anémie
- une occlusion colique
- une maladie métastatique.
Typiquement, la localisation de la tumeur modifie la présentation clinique :
- lorsque la tumeur est dans le côlon gauche, il y a plus fréquemment un changement dans les habitudes intestinales et de l'hématochézie
- lorsque la tumeur est dans le côlon droit, il y a plus fréquemment une anémie obscure (diagnostic plus tardif).
Examen clinique
Dans les stades précoces du cancer colorectal, l'examen physique du patient sera normal. Cependant, lorsque la maladie progresse, des signes cliniques pourront être objectivés.
À l'examen physique, on pourra retrouver les signes suivants :
- à l'examen de l'abdomen :
- un péristaltisme augmenté
- une matité ou un empâtement au niveau de la néoplasie
- une sensibilité à la palpation abdominale au niveau de la néoplasie
- des signes d'occlusion colique
- s'il y a une maladie avancée :
- des irrégularités du rebord hépatique
- un nodule ombilical (nodule de Soeur Marie Joseph)
- l'ascite
- l'hépatomégalie
- au toucher rectal, on peut retrouver :
- une masse rectale palpable (si la néoplasie est rectale) et du sang sur le doigt (hématochézie ou méléna)
- des nodules rectaux au cul-de-sac de Douglas (signe de Blumer's shelf)
- à l'examen cutané, on recherche le signe de Leser-Trélat
- à l'examen des aires ganglionnaires, on recherche des adénopathies et un nodule de Virchow.
La présentation tardive de la maladie métastatique au moment du diagnostic dépendra des symptômes au niveau de l'organe affecté par la voie de propagation : vers le foie via le système porte, vers les poumons via la veine cave inférieure, vers l'adénopathie supraclaviculaire via le système lymphatique ou vers les structures voisines par invasion contiguë.
Examens paracliniques
Laboratoire
Le bilan de routine pour tous les cas est :
- la FSC
- le bilan martial
- les ions
- la créatininémie
- la calcémie
- le bilan hépatique
- l'INR et le TCA.
Un antigène carcinoembryonnaire[Se: 46 %][Sp: 89 %] (ACE ou CEA) supérieur à 5 ng/mL a une valeur pronostique défavorable lorsqu'il est présent. Le dosage préopératoire de l'ACE est indiqué pour tous les cas de cancer du côlon récemment diagnostiqués. Une normalisation du taux après la résection chirurgicale est attendue et des dosages en série doivent être contrôlés lors des visites de suivi aux trois mois.
Également, les cancers colorectaux libèrent souvent des quantités microscopiques de sang et d'ADN anormal dans les selles. Le test d'ADN dans les selles peut détecter des marqueurs de sang ou d'ADN anormal, mais n'est pas utilisé en clinique.
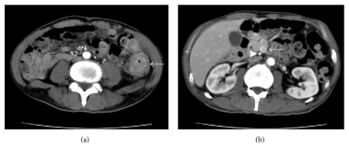
Imageries
L'évaluation initiale peut impliquer un lavement baryté ou une colonographie par TDM, mais une coloscopie est finalement nécessaire pour une biopsie tissulaire.[19][20][21]
La tomodensitométrie thoraco-abdomino-pelvienne avec contraste permet la stadification avant la résection chirurgicale du cancer du côlon. La tomodensitométrie de l'abdomen et du pelvis fournit une sensibilité immédiate plus élevée pour les métastases à distance (87 %) que pour les stades T (50 %) et N (73 %). La tomodensitométrie thoracique reste controversée, car 9 % d'entre elles montrent des lésions indéterminées, dont 11 % sont des lésions métastatiques.
La résonance magnétique hépatique et l'imagerie à triple phase du TDM ont amélioré la détection des métastases hépatiques. La tomographie par émission de positons n'est pas indiquée de manière systématique pour la stadification préopératoire du cancer du côlon. Une biopsie du site métastatique suspect doit être effectuée pour confirmer le diagnostic.
Endoscopie
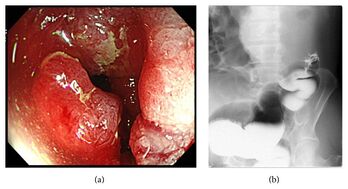
La coloscopie[Se: 94,7 %] permet au clinicien de voir la muqueuse de tout le côlon, y compris le rectum. La coloscopie peut manquer le diagnostic dans 2 à 6 % des cas, principalement du côté droit, selon la qualité de la préparation et l'expérience des intervenants. Après la biopsie, le tatouage de la lésion est conseillé afin de retrouver le site tumoral lors de l'intervention chirurgicale.
La sigmoïdoscopie flexible ne remplace pas une coloscopie diagnostique complète, mais reste une modalité de dépistage qui réduit la mortalité liée au cancer colorectal. La sigmoïdoscopie permet au clinicien de visualiser directement la muqueuse du rectum et la partie inférieure du côlon (le côlon descendant). Elle n'est toutefois plus utilisée et a été remplacée par une coloscopie longue de facto.
Histopathologie
La majorité de tous les cancers colorectaux sont des carcinomes, dont plus de 90 % sont des adénocarcinomes et les autres sont peu fréquents (adénosquameux, fusiforme, squameux et indifférencié). Les adénocarcinomes du cancer du côlon peuvent être encore différenciés en adénocarcinomes cribriformes de type comédonien, médullaires, micropapillaires, dentelés, mucineux et à cellules en bague à chaton. Les adénocarcinomes sont classés en fonction du pourcentage de formation de glandes : bien différenciés (plus de 95 %), modérément différenciés (plus de 50 %) et peu différenciés (moins de 49 %). Ils sont ensuite divisés en deux catégories : bas grade (bien-modéré)/haut grade (pauvre), avec une signification pronostique.
| Type morphologique | |
|---|---|
| Adénocarcinomes
(90 % des cancers) |
|
| Autres types |
|
Approche clinique
| Stade | Caractéristiques |
|---|---|
| Tis | Carcinome in situ intraépithélial ou envahissement de la lamina propria (Cancer in-situ = dysplasie haut grade = Ca intraépi)[note 2] |
| T1 | Envahissement de la sous-muqueuse |
| T2 | Envahissement du muscle propre |
| T3 | Envahissement de la sous-séreuse ou des tissus péricolique/périrectaux |
| T4 | a) Envahissement du péritoine viscéral
b) Envahissement ou adhérence à d'autres organes/structures[note 3] |
| N1 | 1-3 gg+ (1a = 1gg; b = 2-3 gg; c = dépôts tumoraux)[note 4] |
| N2 | 4 ou plus gg+ (N2a = 4-6 gg; N2b = 7 ou plus gg) |
| M1a | Métastase à UN organe ou site |
| M1b | Métastases à 2 sites ou carcinomatose péritonéale |
| Stade | |
| I | T1-2, N0 |
| II | T3-4, N0 |
| III | N+ |
| IV | M+ |
Diagnostic
Le diagnostic du cancer colorectal s'effectue par biopsie de zones du côlon suspectes d'un éventuel développement tumoral, généralement au cours d'une coloscopie selon la localisation de la lésion. Il est confirmé par un examen d'un échantillon tissulaire en pathologie.
La plupart des cancers colorectaux sont diagnostiqués :
- par coloscopie diagnostique en cas de signes et symptômes suspects (80 %)
- lors d'un dépistage de routine (11 %)
- par découverte fortuite lors d'une admission pour des douleurs abdominales aiguës (7 %).
Les patients diagnostiqués dans le cadre d'un dépistage de routine du cancer sont souvent à un stade plus précoce par rapport à la maladie avancée des découvertes chirurgicales fortuites.
Diagnostic différentiel
Quelques diagnostics différentiels à éliminer sont[22] :
- une malformation artério-veineuse
- les tumeurs carcinoïdes
- la maladie de Crohn
- le lymphome gastro-intestinal
- l'ischémie intestinale
- l'ileus
- le carcinome de l'intestin grêle
- la diverticulose (sténose diverticulaire)
- la colite ulcéreuse.
Traitement
Traitement chirurgical
| Type de traitement chirurgical | Explications |
|---|---|
| Traitement des complications tumorales (en urgence) | 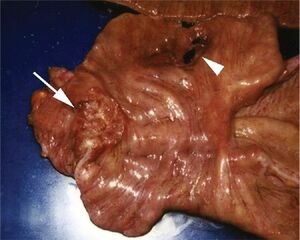
|
| Résection par endoscopie |
|
| Résection chirurgicale |
|
| Chirurgie palliative |
|
Traitement médical
| Modalité de traitement médical | Explications |
|---|---|
| Chimiothérapie adjuvante |
|
| Radiothérapie |
|
| Maladie métastatique traitable |
|
| Chimiothérapie palliative |
|
Suivi
Le suivi du cancer colorectal est très important, car il s'agit du seul type de suivi pour un cancer qui ait été prouvé efficace pour augmenter l'espérance de vie des patients.
| Test diagnostique | Recommandations |
|---|---|
| Histore et examen physique | Aux 3 à 6 mois durant les 3 premières années suite au traitement et aux 6 à 12 mois pour 2 ans. |
| Dosage de la CEA | Aux 3 à 6 mois durant les 3 premières années suite au traitement et aux 6 à 12 mois pour 2 ans. |
| Imagerie thoracique | TDM aux 6 à 12 mois durant les 3 premières années suite au traitement. |
| Imagerie abdominale | TDM aux 6 mois durant les 3 premières années suite au traitement et ensuite annuellement pour 2 ans. |
| Coloscopie | À faire 1 an après la chirurgie. Si normal, refaire aux 3 à 5 ans. Si anormal (ex : présence de polypes), refaire à chaque année. |
Le taux de CEA renseigne sur le pronostic du patient. Plus le taux de CEA est élevé, moins le pronostic est bon. Si le dosage de la CEA en post-opératoire n’est pas revenu à la normale, cela signifie que la résection a été incomplète ou qu’il y a présence de métastases occultes. Lorsque c’est le cas, il faut recontrôler le taux de CEA et faire une TDM; si la TDM s'avère normale, on refait une côlonoscopie. De même, une élévation de la CEA au-dessus du taux normal peut précéder l’apparition clinique de récidive de 6 à 9 mois. Cependant, il faut faire attention puisque le taux de CEA peut être physiologiquement augmenté dans certains cas[note 5].
Complications
Le cancer colorectal peut se compliquer entre autres :
- d'anémie
- d'hémorragie digestive basse
- d'occlusion intestinale
- de perforation intestinale
- de fractures pathologiques
- de convulsions en raison d'une métastase
- d'ascite
- de thrombose veineuse profonde et d'embolie pulmonaire.
Le type de colectomie employé peut engendrer diverses complications :
- l'hémocolectomie droite peut causer des traumatismes de l'uretère, des traumatismes au duodénum ou encore engendrer une malabsorption de la bile
- l'hémicolectomie droite étendue peut causer de la diarrhée au patient
- l'hémicolectomie gauche peut également se compliquer de traumatismes de l'uretère.
Évolution
La survie globale à 5 ans pour le cancer colique est de 65 %. La survie à 5 ans par stade est :
- I : 93,2 %
- II : 82,5 %
- III : 59,5 %
- IV : 8,1 %.
Seulement 10 % de ces récidives sont résécables. Les facteurs pronostiques du cancer colique sont les suivants :
- le stade T et N (risques de métastases selon le stade T : T1 = 10 %, T2 = 25 %, T3 = 45 %)
- la résection R0
- la marge radiale > 1 mm pour considérer négative
- le degré de différentiation
- les dépôts tumoraux
- l'invasion lymphovasculaire et invasion péri-neurale
- l'histologie (à petites cellules, bague à chaton ou non différencié sont associés à un moins bon pronostic)
- la réponse immune
- le statut K-ras[note 6]
- l'index de prolifération
- la perte d’allèle chromosome 18q (18q LOH assay, LOH = loss of heterozygosity)
- le DCC (deleted in colorectal cancer).
La taille n’influence pas le pronostic, c’est le degré d’invasion qui importe.
Prévention
Plusieurs facteurs environnementaux et habitudes de vie peuvent contribuer à diminuer le risque de cancer du côlon. L'activité physique régulière ainsi qu'un apport suffisant en folate sont associés à une diminution probable du risque de cancer colique. Il faut également encourager l'apport suffisant de calcium et de vitamine D et une consommation de fruits et légumes étant donné qu'ils sont également associés à une diminution possible du risque de cancer colique.
Notes
- ↑ La maladie inflammatoire de l'intestin (MII), principalement la colite ulcéreuse, a une association bien connue avec le cancer du côlon, avec une incidence estimée à 0,5 % par an entre 10 et 20 ans après le diagnostic de la MII et 1 % par an par la suite, atteignant 30 % de risque d'ici la quatrième décennie des patients atteints de pancolite. La maladie de Crohn peut augmenter le risque de cancer colique, en particulier si elle se présente dans la région iléocolique.
- ↑ L’invasion de la lamina propria et muscularis mucosae ne fait PAS un cancer invasif. Il faut atteindre la sous-muqueuse.
- ↑ Si aucune cellule tumorale retrouvée dans l’adhérence tumorale il faut déclasser à inférieur (T1 à 4a).
- ↑ Dépôt tumoral séreuse, mésentère tissu péri-colique non-péritonéalisé SANS atteinte ganglionnaire.
- ↑ Faux positifs du CEA si : tabac, MII, pancréatite, néoplasie bénigne, cirrhose, infections pulmonaires, autres cancers, 5FU
- ↑ Wild = non muté, si muté = pas d’anticorps monoclonaux
Références
- Cette page a été modifiée ou créée le 2021/05/26 à partir de Colon Cancer (StatPearls / Colon Cancer (2021/01/25)), écrite par les contributeurs de StatPearls et partagée sous la licence CC-BY 4.0 international (jusqu'au 2022-12-08). Le contenu original est disponible à https://www.ncbi.nlm.nih.gov/pubmed/29262132 (livre).
- Cet article a été créé en partie ou en totalité le 2021/07/05 à partir de Chirurgie (application), créée par Dre Hélène Milot, Dr Olivier Mailloux et collaborateurs et partagé sous la licence CC-BY-SA 4.0 international
- ↑ 1,0 et 1,1 Alejandro Recio-Boiles et Burt Cagir, StatPearls, StatPearls Publishing, (PMID 29262132, lire en ligne)
- ↑ (en) « Cancer today », sur gco.iarc.fr (consulté le 23 juin 2021)
- ↑ Global Burden of Disease Cancer Collaboration, Christina Fitzmaurice, Christine Allen et Ryan M. Barber, « Global, Regional, and National Cancer Incidence, Mortality, Years of Life Lost, Years Lived With Disability, and Disability-Adjusted Life-years for 32 Cancer Groups, 1990 to 2015: A Systematic Analysis for the Global Burden of Disease Study », JAMA oncology, vol. 3, no 4, , p. 524–548 (ISSN 2374-2445, PMID 27918777, Central PMCID 6103527, DOI 10.1001/jamaoncol.2016.5688, lire en ligne)
- ↑ (en) « Colorectal cancer statistics - Canadian Cancer Society », sur www.cancer.ca (consulté le 29 juillet 2021)
- ↑ 5,0 et 5,1 Chyke A. Doubeni, Adeyinka O. Laiyemo, Jacqueline M. Major et Mario Schootman, « Socioeconomic status and the risk of colorectal cancer: an analysis of more than a half million adults in the National Institutes of Health-AARP Diet and Health Study », Cancer, vol. 118, no 14, , p. 3636–3644 (ISSN 1097-0142, PMID 22898918, Central PMCID 3422782, DOI 10.1002/cncr.26677, lire en ligne)
- ↑ Chyke A. Doubeni, Jacqueline M. Major, Adeyinka O. Laiyemo et Mario Schootman, « Contribution of behavioral risk factors and obesity to socioeconomic differences in colorectal cancer incidence », Journal of the National Cancer Institute, vol. 104, no 18, , p. 1353–1362 (ISSN 1460-2105, PMID 22952311, Central PMCID 3529596, DOI 10.1093/jnci/djs346, lire en ligne)
- ↑ Carrie N. Klabunde, Kathleen A. Cronin, Nancy Breen et William R. Waldron, « Trends in colorectal cancer test use among vulnerable populations in the United States », Cancer Epidemiology, Biomarkers & Prevention: A Publication of the American Association for Cancer Research, Cosponsored by the American Society of Preventive Oncology, vol. 20, no 8, , p. 1611–1621 (ISSN 1538-7755, PMID 21653643, Central PMCID 3153583, DOI 10.1158/1055-9965.EPI-11-0220, lire en ligne)
- ↑ Carrie Snyder et Heather Hampel, « Hereditary Colorectal Cancer Syndromes », Seminars in Oncology Nursing, vol. 35, no 1, , p. 58–78 (ISSN 1878-3449, PMID 30665732, DOI 10.1016/j.soncn.2018.12.011, lire en ligne)
- ↑ Stephanie A. Bien, Yu-Ru Su, David V. Conti et Tabitha A. Harrison, « Genetic variant predictors of gene expression provide new insight into risk of colorectal cancer », Human Genetics, vol. 138, no 4, , p. 307–326 (ISSN 1432-1203, PMID 30820706, Central PMCID 6483948, DOI 10.1007/s00439-019-01989-8, lire en ligne)
- ↑ Habib Malekpour, Mohammad Hossein Heidari, Reza Vafaee et Hamideh Moravvej Farshi, « Gene expression analysis of colon high-grade dysplasia revealed new molecular mechanism of disease », Gastroenterology and Hepatology from Bed to Bench, vol. 11, no Suppl 1, , S111–S117 (ISSN 2008-2258, PMID 30774816, Central PMCID 6347998, lire en ligne)
- ↑ Sid Lee, « Facteurs de risque du cancer colorectal », sur Société canadienne du cancer (consulté le 7 juin 2023)
- ↑ Andrew T. Chan et Edward L. Giovannucci, « Primary prevention of colorectal cancer », Gastroenterology, vol. 138, no 6, , p. 2029–2043.e10 (ISSN 1528-0012, PMID 20420944, Central PMCID 2947820, DOI 10.1053/j.gastro.2010.01.057, lire en ligne)
- ↑ R. W. Burt, J. A. DiSario et L. Cannon-Albright, « Genetics of colon cancer: impact of inheritance on colon cancer risk », Annual Review of Medicine, vol. 46, , p. 371–379 (ISSN 0066-4219, PMID 7598472, DOI 10.1146/annurev.med.46.1.371, lire en ligne)
- ↑ Béatrice Lauby-Secretan, Chiara Scoccianti, Dana Loomis et Yann Grosse, « Body Fatness and Cancer--Viewpoint of the IARC Working Group », The New England Journal of Medicine, vol. 375, no 8, , p. 794–798 (ISSN 1533-4406, PMID 27557308, Central PMCID 6754861, DOI 10.1056/NEJMsr1606602, lire en ligne)
- ↑ Amalia Karahalios, Dallas R. English et Julie A. Simpson, « Weight change and risk of colorectal cancer: a systematic review and meta-analysis », American Journal of Epidemiology, vol. 181, no 11, , p. 832–845 (ISSN 1476-6256, PMID 25888582, DOI 10.1093/aje/kwu357, lire en ligne)
- ↑ Ann Chao, Michael J. Thun, Cari J. Connell et Marjorie L. McCullough, « Meat consumption and risk of colorectal cancer », JAMA, vol. 293, no 2, , p. 172–182 (ISSN 1538-3598, PMID 15644544, DOI 10.1001/jama.293.2.172, lire en ligne)
- ↑ Manami Inoue, Motoki Iwasaki, Tetsuya Otani et Shizuka Sasazuki, « Diabetes mellitus and the risk of cancer: results from a large-scale population-based cohort study in Japan », Archives of Internal Medicine, vol. 166, no 17, , p. 1871–1877 (ISSN 0003-9926, PMID 17000944, DOI 10.1001/archinte.166.17.1871, lire en ligne)
- ↑ Tara O. Henderson, Kevin C. Oeffinger, John Whitton et Wendy Leisenring, « Secondary gastrointestinal cancer in childhood cancer survivors: a cohort study », Annals of Internal Medicine, vol. 156, no 11, , p. 757–766, W–260 (ISSN 1539-3704, PMID 22665813, Central PMCID 3554254, DOI 10.7326/0003-4819-156-11-201206050-00002, lire en ligne)
- ↑ Heather Dawson, Richard Kirsch, David Messenger et David Driman, « A Review of Current Challenges in Colorectal Cancer Reporting », Archives of Pathology & Laboratory Medicine, vol. 143, no 7, , p. 869–882 (ISSN 1543-2165, PMID 30672337, DOI 10.5858/arpa.2017-0475-RA, lire en ligne)
- ↑ Manjunath K N, Siddalingaswamy P C et G. K. Prabhu, « Domain-Based Analysis of Colon Polyp in CT Colonography Using Image-Processing Techniques », Asian Pacific journal of cancer prevention: APJCP, vol. 20, no 2, , p. 629–637 (ISSN 2476-762X, PMID 30806070, Central PMCID 6897007, DOI 10.31557/APJCP.2019.20.2.629, lire en ligne)
- ↑ Ian S. Grimm et Sarah K. McGill, « Look, but don't touch: what not to do in managing large colorectal polyps », Gastrointestinal Endoscopy, vol. 89, no 3, , p. 479–481 (ISSN 1097-6779, PMID 30784495, DOI 10.1016/j.gie.2018.10.008, lire en ligne)
- ↑ Alejandro Recio-Boiles et Burt Cagir, StatPearls, StatPearls Publishing, (PMID 29262132, lire en ligne)
- ↑ João Cortez Pinto, Isadora Rosa, Catarina Martins et Inês Marques, « Colon Adenocarcinoma Stage IIA-Can We Predict Relapse? », Journal of Gastrointestinal Cancer, vol. 51, no 1, , p. 116–120 (ISSN 1941-6636, PMID 30834501, DOI 10.1007/s12029-019-00218-9, lire en ligne)
- ↑ Qi Liu, Yongqiang Huang, Dakui Luo et Sheng Zhang, « Evaluating the Guiding Role of Elevated Pretreatment Serum Carcinoembryonic Antigen Levels for Adjuvant Chemotherapy in Stage IIA Colon Cancer: A Large Population-Based and Propensity Score-Matched Study », Frontiers in Oncology, vol. 9, , p. 37 (ISSN 2234-943X, PMID 30815388, Central PMCID 6381003, DOI 10.3389/fonc.2019.00037, lire en ligne)
- ↑ Ainhoa Costas-Chavarri, Govind Nandakumar, Sarah Temin et Gilberto Lopes, « Treatment of Patients With Early-Stage Colorectal Cancer: ASCO Resource-Stratified Guideline », Journal of Global Oncology, vol. 5, , p. 1–19 (ISSN 2378-9506, PMID 30802158, Central PMCID 6426503, DOI 10.1200/JGO.18.00214, lire en ligne)
- ↑ 26,0 26,1 26,2 26,3 et 26,4 « ALGORITHMES D’INVESTIGATION, DE TRAITEMENT ET DE SUIVI du CANCER DU CÔLON », sur INESSS, (consulté le 29 juillet 2021)