« Pneumothorax » : différence entre les versions
(Ajout des 4 modèles) |
|||
| Ligne 525 : | Ligne 525 : | ||
| pmid = 30855900 | | pmid = 30855900 | ||
| nom = Acute Pneumothorax Evaluation and Treatment | | nom = Acute Pneumothorax Evaluation and Treatment | ||
|url=}}<references /> | |url=}} | ||
<references /> | |||
Version du 4 janvier 2021 à 23:59
| Classe de maladie | |
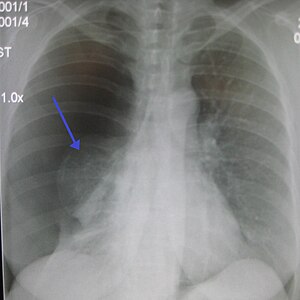 Un important pneumothorax primaire droit, la flèche montre le poumon collabé | |
| Caractéristiques | |
|---|---|
| Signes | Tachycardie , Tirage , Tachypnée , Emphysème sous-cutané, Diminution du murmure vésiculaire unilatérale, Diminution des vibrations vocales unilatérale, Tympanisme thoracique, Diminution de l’amplitude thoracique ipsilatérale, Augmentation du volume thoracique ipsilatéral, Déviation de la trachée du côté ipsilatéral, ... [+] |
| Symptômes |
Dyspnée , Douleur à l'épaule, Douleur thoracique , Toux , Douleur pleurétique , Asymptomatique |
| Étiologies |
Maladie pulmonaire obstructive chronique, Cause idiopathique, Néoplasie pulmonaire, Endométriose, Fibrose kystique, Fistule bronchopulmonaire, Ventilation à pression positive, Biopsie pulmonaire à l'aiguille, Cathétérisme veineux central, Perforation oesophagienne, ... [+] |
| Informations | |
| Wikidata ID | Q203601 |
| Spécialités | Pneumologie, chirurgie générale, chirurgie thoracique |
|
| |
Un pneumothorax est défini comme une accumulation d'air à l'extérieur du poumon mais à l'intérieur de la cavité pleurale.[1]
Épidémiologie
Le pneumothorax spontané primaire survient principalement entre 20 et 30 ans. Son incidence aux États-Unis est de 7 pour 100 000 hommes et de 1 pour 100 000 femmes par an [2]. La majorité des récidives surviennent au cours de la première année et l'incidence de celles-ci varie largement de 25% à 50%. Le taux de récidive est le plus élevé au cours des 30 premiers jours. [1]
Le pneumothorax spontané secondaire est plus observé chez les patients âgés de 60 à 65 ans. Son incidence est de 6,3 pour 1000 000 hommes et 2 pour 100 000 femmes. Le ratio homme / femme est de 3:1.[1]
L'incidence du pneumothorax iatrogène est de 5 pour 10000 admissions à l'hôpital.[1] Il survient plus fréquemment que le pneumothorax spontané[1], et son incidence est directement proportionnelle au nombre de procédures invasives effectuées[3].
L'incidence du pneumothorax sous tension est difficile à déterminer car un tiers des cas dans les centres de traumatologie présentaient des thoracostomies à l'aiguille de décompression avant d'arriver à l'hôpital, et tous n'étaient pas atteints de pneumothorax sous tension.[1]
Étiologies
Il existe deux types de pneumothorax: traumatique et atraumatique. Les deux sous-types de pneumothorax atraumatique sont primaires et secondaires.[1] Le pneumothorax spontané primaire (PSP) survient lorsque le patient n'a pas d'antécédents de maladie pulmonaire sous-jacente, tandis que le pneumothorax spontané secondaire (SSP) est associé à des antécédents de maladie pulmonaire sous-jacente.[4][5]
Un pneumothorax traumatique peut être le résultat d'un traumatisme thoracique contondant ou pénétrant.[1]
Il existe aussi un autre type de pneumothorax: le pneumothorax iatrogène, qui survient en raison d'une complication d'une procédure médicale ou chirurgicale. Toute intervention à proximité de l'abdomen, en particulier du thorax, peut provoquer un pneumothorax iatrogène.[5] Toutefois, la principale cause de pneumothorax iatrogène est la biopsie pulmonaire à l'aiguille (transthoracique et transbronchique), et la deuxième cause principale est le cathétérisme veineux central, puis la ventilation à pression positive peut aussi être une cause de pneumothorax iatrogène.[1][6]
En résumé, il est possible de classifier les pneumothorax selon leur étiologie:
- Spontané
- Primaire
- Absence de maladie pulmonaire sous-jacente
- Secondaire
- Présence d'une maladie pulmonaire sous-jacente: MPOC, Fibrose kystique, Infection pulmonaire, Néoplasie pulmonaire
- Primaire
- Traumatique
- Iatrogène
- Autre[7]
- Par perforation oesophagienne
- cataménial (très rare)
- c'est-à-dire associé aux règles secondaires à l'endométriose thoracique[8]
Il faut savoir qu'il existe aussi la notion de pneumothorax occulte [9]:
- Un pneumothorax occulte est défini comme un pneumothorax visible au TDM, mais non-visible à la radiographie pulmonaire[9]
- Un pneumothorax occulte peut aussi se présenter comme un pneumothorax résiduel suite à un drainage pleural par tube de thoracostomie qui est visible au TDM, mais non-visible à la radiographie pulmonaire[9]
Physiopathologie
Un pneumothorax se produit lorsque de l'air s'accumule entre les plèvres pariétale et viscérale à l'intérieur de la poitrine. L'accumulation d'air peut exercer une pression sur le poumon et le faire s'effondrer. Le degré de collapsus détermine la présentation clinique du pneumothorax. L'air peut pénétrer dans l'espace pleural par deux mécanismes, soit par un traumatisme provoquant une communication à travers la paroi thoracique, soit par le poumon par rupture de la plèvre viscérale.[1]
Le gradient de pression à l'intérieur du thorax change avec un pneumothorax. Normalement, la pression de l'espace pleural est négative par rapport à la pression atmosphérique. Lorsque la paroi thoracique se dilate vers l'extérieur, le poumon se dilate également vers l'extérieur en raison de la tension superficielle entre les plèvre pariétale et viscérale. Les poumons ont tendance à s'affaisser en raison du recul élastique.[1]
Lorsqu'il y a communication entre les alvéoles et l'espace pleural, l'air remplit cet espace, ce qui change le gradient de pression à l'intérieur du thorax. L'équilibre de l'unité de collapsus pulmonaire est alors atteint, ou la rupture est scellée. Le pneumothorax grossit et le poumon devient plus petit en raison de cette capacité vitale, et la pression partielle d'oxygène diminue.[1]
Le pneumothorax spontané chez la majorité des patients survient en raison de la rupture de bulles d'emphysème. Le pneumothorax spontané primaire est défini comme survenant chez des patients sans maladie pulmonaire sous-jacente, mais ces patients avaient des bulles ou des bulles asymptomatiques à la thoracotomie. Le pneumothorax spontané primaire se produit chez les jeunes grands et minces en raison de forces de cisaillement accrues ou d'une pression plus négative à l'apex du poumon. L'inflammation pulmonaire et le stress oxydatif sont essentiels à la pathogenèse du pneumothorax spontané primaire. Les fumeurs actifs ont une augmentation des cellules inflammatoires dans les petites voies respiratoires et courent donc un risque accru de pneumothorax.[1]
Le pneumothorax spontané est un processus multifactoriel et a été associé à des augmentations de la pression transpulmonaire et à des anomalies de la plèvre viscérale. Des augmentations aiguës de la pression alvéolaire qui dépassent la pression interstitielle pulmonaire peuvent entraîner une rupture alvéolaire et une fuite d'air pleural. En outre, des points de faiblesse dans la plèvre viscérale dus à des bulles sous-pleurales, des bulles, une nécrose pulmonaire et d'autres anomalies du tissu conjonctif peuvent prédisposer les alvéoles à se rompre dans les deux types de pneumothorax spontané, bien que le mécanisme exact de la façon dont cela ne soit pas entièrement compris. Des bulles intactes sans défaut explicite de la plèvre viscérale se sont avérées associées à un pneumothorax spontané; cependant, les analyses histopathologiques et les études au microscope électronique à balayage des tissus obtenus à partir de thoracotomies suggèrent que la desquamation des cellules pleurales mésothéliales peut jouer un rôle significatif dans le développement du pneumothorax spontané.[10][11][8]
Les pneumothorax traumatiques peuvent résulter d'un traumatisme contondant ou pénétrant, ceux-ci créent souvent une valve unidirectionnelle dans l'espace pleural (laissant l'air entrer mais pas sortir) et donc un compromis hémodynamique.[1]
Les pneumothorax peuvent être aussi classés comme simples, sous tension ou ouverts. Un pneumothorax simple ne déplace pas les structures médiastinales comme le fait un pneumothorax sous tension. Le pneumothorax sous tension survient le plus souvent dans les services de soins intensifs, chez les patients ventilés à pression positive, il survient lorsque la pression dans l'espace pleural est positive tout au long du cycle respiratoire[5]. Le pneumothorax ouvert, lui, est une plaie ouverte dans la paroi thoracique à travers laquelle l'air entre et sort.[1]
Présentation clinique
Facteurs de risque
Facteurs de risque de pneumothorax spontané primaire [1]:
- sexe masculin
- Âge dans la vingtaine
- grande taille
- morphologie mince
- tabac
- Le risque de pneumothorax spontané chez les gros fumeurs est 102 fois plus élevé que chez les non-fumeurs[1]
- grossesse
- syndrome de Marfan
- histoire familiale de pneumothorax
- histoire personnelle de pneumothorax
Maladies associées à un pneumothorax spontané secondaire [1]:
- maladie pulmonaire obstructive chronique (MPOC)
- 26 pneumothorax sur 100 000 sont associés à une MPOC[12]
- asthme
- pneumonie (par exemple: nécrosante, à pneumocystis (VIH))[8]
- Le pneumothorax chez un patient portant du VIH est souvent associé à pneumocystis jiroveci ou carinii[7]
- abcès pulmonaire[8]
- tuberculose
- Maladie pulmonaire interstitielle[8]
- fibrose kystique
- Maladie du tissu conjonctif[8]
- carcinome bronchogène
- ARDS sévère (Acute Respiratory Distress Syndrome)
- histiocytose à cellules de Langerhans
- consommation de drogues par inhalation comme la cocaïne ou la marijuana
- infarctus pulmonaire[8]
- aspiration de corps étrangers[8]
- syndrome de Birt-Hogg-Dube[8]
Procédures et situations médicales mettant à risque de pneumothorax iatrogène [1]:
- insertion sous-clavière d'un cathéter veineux central[13][5]
- particulièrement si la procédure se fait sans l'utilisation d'ultrasons (c'est-à-dire «aveuglément») en utilisant des repères[14]
- six erreurs techniques courantes au cours de cette procédure peuvent entraîner un pneumothorax[14]:
- une identification inadéquate du repère
- une mauvaise position d'insertion
- l'insertion de l'aiguille à travers le périoste
- une trajectoire trop peu profonde avec l'aiguille
- une trajectoire de l'aiguille à angle céphalique excessif
- le fait de ne pas maintenir l'aiguille en place pour le passage du fil
- biopsie pleurale
- biopsie pulmonaire transbronchique
- biopsie du nodule pulmonaire transthoracique
- ventilation à pression positive
- trachéotomie
- bloc nerveux intercostal
- Patient en situation de traumatisme instable ou de code[13][5]
- plus susceptible de subir une intervention invasive
- associé à un accès limité aux sites jugulaires internes lorsqu'un site veineux non fémoral est souhaité: entraîne un risque élevé de pneumothorax iatrogène
- placement incorrect d'un kit de nébulisation chez un patient intubé à respiration spontanéeme instable[15]
- insertion d'un stimulateur nerveux hypoglosse[16]
- acupuncture[17]
- manque de capacité et d'expérience du professionnel de la santé effectuant la procédure[14]
- surtout en hôpital d'enseignement tertiaire
Événements mettant à risque de pneumothorax traumatique [1]:
- traumatisme pénétrant ou traumatisme contondant
- fracture des côtes
- plongée sous-marine ou vol d'avion
Facteurs de risque du pneumothorax sous tension [1]:
- traumatisme pénétrant ou traumatisme contondant
- barotraumatisme dû à la ventilation à pression positive
- trachéotomie percutanée
- conversion d'un pneumothorax spontané en sous tension
- pneumothorax ouvert lorsque le pansement occlusif fonctionne comme une valve unidirectionnelle
Facteurs de risque de pneumothorax occulte [9]:
- emphysème sous-cutané
- seul facteur de risque toujours significatif
- mais son absence ne permet pas d'exclure la présence d'un pneumothorax occulte
- contusion pulmonaire
- fracture costale
- contusion de la paroi thoracique
Questionnaire
La présentation clinique d'un pneumothorax peut aller de la douleur asymptomatique à la douleur thoracique et à l'essoufflement.
Voici les éléments à rechercher au questionnaire si suspicion de pneumothorax spontané [1]:
- douleur thoracique pleurétique aiguë et sévère unilatérale
- en particulier chez les patients atteints de pneumothorax spontané secondaire[8]
- douleur thoracique qui irradie vers l'épaule ipsilatérale
- dyspnée d'apparition subite
- Symptômes survenus au repos[8]
- sans antécédent de composante d'effort
- Peu de symptômes (si pneumothorax spontané primaire)
- car des individus par ailleurs en bonne santé tolèrent bien les conséquences physiologiques
Dans le pneumothorax spontané secondaire [1]:
- Dyspnée plus sévère
- en raison d'une diminution de la réserve pulmonaire sous-jacente
Dans le cas d'un pneumothorax cataménial [7]:
- douleur thoracique
- dyspnée
- hémoptysies
- Symptômes survenant dans les 72 heures suivant le début des menstruations
Examen clinique
Chez les patients présentant un pneumothorax plus petit (moins de 15% de l'hémithorax), l'examen peut être sans particularité.
À l'examen physique d'un pneumothorax plus important (plus de 15% de l'hémithorax), les constatations suivantes sont notées [1]:
- inconfort respiratoire
- tachypnée
- tachycardie[8]
- l'une des constatations les plus courantes de l'examen physique
- examen pulmonaire:
- emphysème sous-cutané (quasi-pathognomonique)
Dans le pneumothorax sous tension, des résultats supplémentaires sont observés [1]
- tachycardie de plus de 134 battements par minute
- hypotension
- hypoxémie
- trachée déviée en ipsilatéral
- distension veineuse jugulaire
- cyanose
- arrêt respiratoire
- arrêt cardiaque
Le pneumothorax peut être difficile à diagnostiquer à partir d'un examen physique, en particulier dans une baie de traumatologie bruyante. Cependant, il est essentiel de poser le diagnostic de pneumothorax sous tension lors d'un examen physique.[1]
Examens paracliniques
Les examens suivants peuvent être utilisés pour le diagnostic du pneumothorax:
- Radiographie pulmonaire
- Signes:
- hyperclarté du côté atteint prédominante à l'apex
- déplacement de la ligne pleurale viscérale avec un espace dépourvu de marques pulmonaires entre les deux
- un espace aérien de 2,5 cm est équivalent à un pneumothorax de 30%[1]
- la profondeur du décollement pleural est indicateur de l'importance du pneumothorax[7]
- Un décollement de moins de 2 cm en latéral à la hauteur du hile représente un petit pneumothorax
- Un décollement de plus de 2 cm en latéral à la hauteur du hile représente un gros pneumothorax (correspond à un pneumothorax de plus de 50%)
- emphysème sous-cutané
- Élargissement des espaces intercostaux
- hyperclarté du côté atteint prédominante à l'apex
- Signes d'un pneumothorax sous-tension :
- Une évaluation du parenchyme pulmonaire et des côtes est essentielle pour exclure une cause sous-jacente
- Une radiographie pulmonaire en expiration peut mettre en évidence un pneumothorax discret
- Une radiographie thoracique postéro-antérieure verticale a une sensibilité de 83% pour la détection d'un pneumothorax[18]
- Signes:
- Échographie abdominale étendue pour les traumatismes (E-FAST) [1]
- Outil de diagnostic plus récent pour le pneumothorax
- Diagnostic de pneumothorax posé par:
- absence de glissement pulmonaire
- absence d'artefact de queue de comète
- présence d'un point pulmonaire
- glissement pulmonaire juxtaposé à plèvre non glissante[18]
- Méthode diagnostique très dépendante de l'opérateur
- Sensibilité et Spécificité variables
- Tomodensitométrie thoracique [1]
- Permet de visualiser un pneumothorax occulte[9]
- S'assurer de faire un TDM du thorax au complet[9]
- Plus sensible que la radiographie thoracique, mais entraîne un retard de traitement[18]
- Utile lorsque le diagnostic est incertain, pour les cas complexes ou pour les pneumothorax récidivants[7]
- Indiquée chez un patient ayant subi un traumatisme thoracique, et ce, même si la radiographie pulmonaire est normale[19]
- Car l'incidence de pneumothorax occulte est plus élevée chez les patients traumatisés, et il est important de prévenir l'évolution vers un pneumothorax sous tension[19]
Examens évaluant les conséquences du pneumothorax lorsque la physiologie de la tension est présente (source? pt spontané?):
- Gaz artériel
- évaluer l'alcalose respiratoire aigue
- évaluer les augmentations du gradient d'oxygène alvéolaire-artériel
Approche clinique
Lorsqu'un patient se présente avec une douleur thoracique pleurétique unilatérale ainsi que de la dyspnée, il convient de suspecter un pneumothorax. Il est alors important de s'informer auprès du patient d'antécédents personnels ou familiaux de pneumothorax ainsi que de la présence ou non de maladie pulmonaire sous-jacente. Il est aussi important de suspecter un pneumothorax chez un patient aux soins intensifs ayant eu un cathétérisme veineux central, une biopsie pulmonaire ou une ventilation à pression positive. À l'examen physique, tachycardie, diminution du murmure vésiculaire unilatérale et emphysème sous-cutané orientent fortement vers un pneumothorax. De plus, il faut rester à l'affût de signes tels que trachée déviée, hypotension, hypoxémie et distension veineuse jugulaire qui sont indicateurs de pneumothorax sous tension, ce qui nécessite une prise en charge urgente.
Afin de confirmer la suspicion clinique, l'imagerie de choix est une radiographie pulmonaire. Un décollement de la ligne pleurale à l'apex est observée avec une hyperclarté indiquant un espace dépourvu de marques pulmonaires. Un TDM thoracique peut aussi être effectué, particulièrement chez les patients traumatisés, afin de vérifier la présence d'un pneumothorax occulte. Un gaz artériel est aussi fait afin d'évaluer les possibles conséquences d'un pneumothorax.
Diagnostic
La radiographie thoracique, l'échographie ou la tomodensitométrie peuvent être utilisées pour le diagnostic, bien que le diagnostic à partir d'une radiographie pulmonaire soit plus courant.[1] Ainsi, à la radiographie, voici les signes permettant de diagnostiquer le pneumothorax:
- hyperclarté (noir) du côté atteint
- déplacement de la ligne pleurale viscérale avec un espace dépourvu de marques pulmonaires entre les deux (source? pt spontané?)
- prédominant à l'apex
- emphysème sous-cutané
- élargissement des espaces intercostaux
- déplacement ipsilatéral de la trachée
- si pneumothorax sous tension
Le diagnostic de pneumothorax spontané repose sur une suspicion clinique et peut être confirmé par imagerie.[4][5]
Le pneumothorax iatrogène peut être diagnostiqué cliniquement.[18]
Diagnostic différentiel
Les diagnostics différentiels de pneumothorax comprennent:
- Aspiration, Pneumonie bactérienne ou Pneumonie virale[1]
- Dissection aortique aiguë[1]
- Infarctus du myocarde[1]
- Embolie pulmonaire[1]
- Péricardite aiguë[1]
- Spasme œsophagien[1]
- Rupture œsophagienne[1]
- Fracture des côtes[1]
- Blessure diaphragmatique [1]
- Hémothorax
- Épanchement pleural
- Pleurésie[20]
Traitement
La prise en charge dépend du scénario clinique.[1] Il faut d'abord déterminer si le patient est stable ou instable.[21] Le traitement a priorité sur l'imagerie.
La prise en charge du pneumothorax spontané dépend de plusieurs facteurs, dont la stabilité du patient, la taille du pneumothorax, la survenue (c.-à-d. Premier épisode ou récidive) et le type de pneumothorax.[4][5]
En général, pour les patients avec un pneumothorax minime et sans compromis hémodynamique, une simple observation est acceptable: le patient doit rester au repos et une radiographie de contrôle est faite.
Les patients avec symptômes ainsi des signes d'instabilité hémodynamique (généralement, un pneumothorax de 25% ou plus) doivent recevoir [1]:
- administration d'oxygène
- l'air peut être réabsorbé de l'espace pleural à un taux de 1,5% / jour; l'utilisation d'oxygène supplémentaire peut augmenter ce taux de réabsorption
- en augmentant la fraction de concentration d'oxygène inspirée, l'azote de l'air atmosphérique est déplacé
- ce qui modifie le gradient de pression entre l'air dans l'espace pleural et les capillaires
- décompression à l'aiguille (ou aspiration à l'aiguille)
- avec un angiocathéter de calibre 14 à 16 et de 4,5 cm de longueur
- effectuée juste au-dessus de la côte dans le deuxième espace intercostal de la ligne médioclaviculaire
- l'intervention ne doit pas être suspendue pour attendre l'imagerie
- la décompression à l'aiguille peut être effectuée si le patient est instable du point de vue hémodynamique avec des antécédents et un examen physique convaincants, indiquant un pneumothorax sous tension
- nécessité absolue de décompression à l'aiguille [7]:
- pneumothorax symptomatique
- drainage pleural par tube de thoracostomie
- en cas d'échec de la décompression à l'aiguille
- le tube peut être placé à deux positions[26]:
- Position de Bulau
- au-dessus de la côte dans le quatrième ou le cinquième espace intercostal antérieur à la ligne médio-axillaire
- Position de Monaldi
- dans le deuxième ou le troisième espace intercostal de la ligne médio-claviculaire
- Position de Bulau
- la taille du tube de thoracotomie varie généralement en fonction de
- création d'une pression négative générée par un joint hydraulique ou une aspiration[27]
- pour réduire l'air dans l'espace pleural[27]
- nécessité absolue de drain thoracique [7]:
- instabilité hémodynamique
- pneumothorax bilatéraux
- hydropneumothorax
- nécessité relative de drain thoracique [7]:
- pneumothorax spontané de plus de 50% (> 2 cm)
- échec à une tentative de décompression à l'aiguille (aspiration à l'aiguille) d'un pneumothorax spontané
- ne pas tenter une seconde aspiration!
- complication possible du drainage thoracique: Fuite persistante
- présence de bulles dans le tube pendant plus de 48 heures avec ou sans ré-expansion pulmonaire complète[7]
- traitement: succion à de -10 à 20 cmH2O
- présence de bulles dans le tube pendant plus de 48 heures avec ou sans ré-expansion pulmonaire complète[7]
Différents spécialistes peuvent être à consulter pour le traitement d'un pneumothorax[1]:
- Radiologue interventionnel
- Chirurgien thoracique
- Consultant en pneumologie
Traitement d'un pneumothorax spontané primaire
Pour un premier épisode de petit pneumothorax spontané primaire asymptomatique (profondeur généralement inférieure à 2 cm) [1]:
- Retour à la maison sans traitement
- Si une radiographie thoracique répétée montre des signes d'un pneumothorax stable et que le patient a accès à un suivi adéquat, le patient peut être renvoyé avec des précautions de retour strictes pour un nouveau contrôle de 24 heures [25]
- Suivi en ambulatoire après 2 à 4 semaines
- avec radiographie pulmonaire de contrôle[7]
Pour un premier épisode de pneumothorax spontané primaire symptomatique (ou si la profondeur est supérieure à 2 cm) [1]:
- administration d'oxygène et surveillance cardio-pulmonaire continue[22][23][24][25]
- décompression à l'aiguille
- après l'aspiration;
- si le patient s'améliore et que la profondeur résiduelle est inférieure à 2 cm, le patient est retourné à la maison
- sinon, un drainage pleural par tube de thoracostomie est effectué
Pour les patients atteints de pneumothorax spontané primaire récidivant, la prise en charge consiste en[25]:
- administration d'oxygène et surveillance cardio-pulmonaire continue[22][23][24][25]
- drainage pleural par tube de thoracostomie
- en tant que pont vers une chirurgie thoracique vidéo-assistée (VATS)
- Si un patient ne souhaite pas subir de VATS, est un mauvais candidat à la chirurgie ou est pris en charge dans un établissement où la VATS n'est pas facilement disponible, une pleurodèse chimique peut être réalisée
- en tant que pont vers une chirurgie thoracique vidéo-assistée (VATS)
Traitement d'un pneumothorax spontané secondaire
Aussi refaire une radiographie thoracique.[25]
Pour un pneumothorax spontané secondaire de taille / profondeur inférieure à 1 cm et qu'il n'y a pas de dyspnée [1]:
- Admission du patient
- Observation pendant 24 heures
- Suivi en ambulatoire après 2 à 4 semaines[7]
- avec radiographie pulmonaire de contrôle[7]
Pour un pneumothorax spontané secondaire de taille / profondeur comprise entre 1 et 2 cm [1]:
- La décompression à l'aiguille permet de voir la taille résiduelle du pneumothorax;
- Si la profondeur après l'aspiration à l'aiguille est inférieure à 1 cm:
- administration d'oxygène
- Observation
- Si la profondeur après l'aspiration à l'aiguille est inférieure à 1 cm:
- Si la profondeur après l'aspiration à l'aiguille est de plus de 2 cm:
Pour un pneumothorax spontané secondaire de taille / profondeur de plus de 2 cm ou de dyspnée importante (ou pneumothorax bilatéral[25]) [1]:
- administration d'oxygène et surveillance cardio-pulmonaire continue[22][23][24][25]
- drainage pleural par tube de thoracostomie
- aiguillage vers un spécialiste thoracique[25]
- mais pas tant que le patient n'est pas stabilisé avec un drain thoracique[25]
Traitement d'un pneumothorax traumatique
Un pneumothorax traumatique simple et asymptomatique peut être seulement mis sous observation sans traitement supplémentaire.[7]
- Observation du patient
Le traitement d'une plaie thoracique ouverte aspirante (avec entrée d'air via la paroi thoracique[7]) consiste en [1]:
- pansement occlusif à trois faces (en premier lieu) (fermeture temporaire[7])
- drainage pleural par tube de thoracostomie[7]
- réparation du défaut de la paroi thoracique
En présence d'un hémopneumothorax, il faut faire [7]:
Traitement d'un pneumothorax iatrogène
Le traitement du pneumothorax iatrogène consiste en [7]:
- Observation du patient
- décompression à l'aiguille
- puis, drainage pleural par tube de thoracostomie s'il y a progression
Traitement d'un pneumothorax occulte
En présence d'un pneumothorax occulte asymptomatique, il faut faire [9]:
- Observation du patient
- puis, radiographie pulmonaire le lendemain
- un drainage pleural par tube de thoracostomie est fait si le pneumothorax a progressé
En présence d'un pneumothorax occulte symptomatique, il faut faire [9]:
Traitement d'un pneumothorax sous tension
Les patients cliniquement instables présentant des symptômes sévères ou des symptômes évocateurs d'un pneumothorax sous tension peuvent être traités par [22][23][24][25]:
- décompression à l'aiguille d'urgence
- puis, drainage pleural par tube de thoracostomie
Intervention chirurgicale
Il existe deux types d'approche chirurgicale pour le pneumothorax lorsqu'indiqué: la chirurgie thoracique vidéo-assistée (VATS) ou la thoracotomie. La VATS est moins invasive que la thoracotomie et s'est avéré être une mesure efficace dans le traitement et la prévention de la récidive spontanée de pneumothorax.[25]
Indications de l'intervention chirurgicale (VATS ou thoracotomie) [1]:
- Fuite d'air continue pendant plus de 5-7 jours[7]
- Pneumothorax bilatéraux
- Le premier épisode chez un patient ayant un profession à haut risque (plongeurs, pilotes)
- Récidive de pneumothorax ipsilatéral
- Pneumothorax en controlatéral[7]
- Patients atteints du SIDA[1]
- Hémothorax spontané[7]
- Grossesse[7]
La chirurgie consiste en une bullectomie, une pleurectomie et une pleurodèse.[25] La pleurodèse sert à occlure l'espace pleural. Il existe deux types de pleurodèse [1]:
- pleurectomie', bullectomie'[7] et pleurodèse mécanique
- une abrasion de gaze sèche[25]
- taux de récidive du pneumothorax[7]
- de 5% par VATS
- de 1% par thoracotomie
- options:
- décapage de la plèvre pariétale (pleurectomie)
- ou;
- utilisation d'un tampon abrasif ou d'une gaze sèche (pleurodèse mécanique)
- léger avantage de la pleurectomie par rapport à la pleurodèse mécanique par thoracotomie[7]
- pleurodèse chimique
- introduction d'irritants via le tube de thoracostomie[25] ou via VATS ou via thoracotomie[7]
- les processus inflammatoires associés à la pleurodèse chimique conduisent à la formation d'adhérences pleurales qui oblitèrent efficacement l'espace pleural[25]
- chez les patients frêles, ne pouvant supporter une chirurgie plus extensive[7] (qui peuvent ne pas tolérer la pleurodèse mécanique)
- options (irritants de la muqueuse pleurale pouvant être utilisés):
- talc (meilleur choix[7])
- tétracyclines
- doxycycline
- minocycline
- taux de de récidive de pneumothorax de 10-20% malgré une procédure adéquate[7]
- traitement prouvé inférieur à la pleurectomie
- introduction d'irritants via le tube de thoracostomie[25] ou via VATS ou via thoracotomie[7]
Traitement de certains pneumothorax particuliers
Pour un pneumothorax chez une femme enceinte [7]:
- Risque plus élevé de récidive pendant la grossesse et l'accouchement
- Favoriser accouchement avec épidurale
- Favoriser accouchement vaginal avec assistance (forceps, ventouse, ...) pour diminuer les efforts de la mère
- Si césarienne: favoriser anesthésie régionale plutôt que générale
- Si la patiente souhaite d'autres grossesses dans le futur: Chirurgie thoracique vidéo-assistée (VATS)
Pour un pneumothorax cataménial [7]:
- Par thoracoscopie et thoracotomie
Pour un pneumothorax chez un patient porteur du VIH [7]:
- pleurodèse et pleurectomie bilatérales (traitement agressif)
Pour un pneumothorax chez un patient ayant la fibrose kystique [7]:
- drainage pleural par tube de thoracostomie
- pleurodèse ou pleurectomie
- diminue le taux de récidive à 5%
Suivi
Pour un petit pneumothorax spontané primaire asymptomatique (profondeur généralement inférieure à 2 cm) pour lequel aucun traitement invasif n'est nécessaire, un suivi en ambulatoire est fait après 2 à 4 semaines.[1]
Complications
La complication la plus notable de tout pneumothorax est[28]:
- Le pneumothorax sous tension
- met la vie en danger et nécessite une intervention immédiate
Les complications possibles d'un pneumothorax sont [1]:
- insuffisance respiratoire ou arrêt respiratoire
- arrêt cardiaque
- pyopneumothorax
- empyème
- Œdème pulmonaire
- pneumopéricarde
- pneumopéritoine
- pneumohémothorax
- fistule bronchopulmonaire
- dommages au faisceau neurovasculaire lors d'une thoracostomie tubulaire
- douleur et infection cutanée au site de la thoracostomie du tube
- fuite d'air persistante[29][20]
- Échec de la ré-expansion pulmonaire[29][20]
Évolution
Le pneumothorax spontané primaire (PSP) est généralement bénin et se résout principalement de lui-même sans aucune intervention majeure. La récidive peut survenir jusqu'à trois ans, mais le risque est le plus élevé au cours du premier mois[30][20]. Le taux de récidive dans les cinq années suivantes est de 30% pour les PSP et de 43% pour les PSS. Le risque de récidive augmente avec chaque pneumothorax subséquent; il est de 30% avec le premier, 40% après un deuxième et plus de 50% après la troisième récurrence. Le pneumothorax spontané primaire n'est pas considéré comme une menace majeure pour la santé, mais des décès ont été signalés.[1]
Les pneumothorax spontanés secondaires (PSS) sont plus mortels, tout dépendant de la maladie pulmonaire sous-jacente et de la taille du pneumothorax. Les patients atteints de MPOC et du VIH ont une mortalité élevée après un pneumothorax. Le taux de mortalité du pneumothorax spontané secondaire est de 10%.[1]
La mortalité due au pneumothorax sous tension est élevée si les mesures appropriées ne sont pas prises. [1]
Un pneumothorax à pneumocystis jiroveci ou carinii (chez un patient portant du VIH) a un haut taux de récidive et de fuite persistante ainsi qu'une mortalité élevée.[7]
Prévention
Fait partie de la présentation clinique de ...
Est une complication de ...
Les patients atteints de pneumothorax doivent être informés qu'ils ne doivent pas voyager par avion ou dans des régions éloignées avant la résolution complète du pneumothorax, soit pour un minimum de deux semaines après la résolution de leur pneumothorax. Si le transport aérien est nécessaire, une sonde de thoracostomie doit être placée avant le transport.[1] Chez les patients qui ont subi une thoracostomie par sonde, il est sécuritaire pour eux de voler dès 72 heures après le retrait de la sonde sans risque accru de récidive.[30][20]
Les patients ayant des professions à haut risque comme les plongeurs sous-marins et les pilotes doivent être informés qu'ils ne doivent pas plonger ou voler tant que la prise en charge chirurgicale définitive de leur pneumothorax n'est pas terminée. Les patients ayant des antécédents connus de pneumothorax spontané ne doivent pas être médicalement autorisés à exercer des activités de vol ou de plongée sous-marine[1]. Le pneumothorax est donc une contre-indication formelle à la plongée sous-marine sauf si le patient a subi une pleurectomie bilatérale et qu'il y a eu confirmation de la résolution complète de leur pneumothorax par un TDM thoracique.[7]
Il est conseillé à tous les patients d'arrêter de fumer. Ils devraient être évalués pour leur volonté d'arrêter de fumer; ils doivent être éduqués et recevoir une pharmacothérapie s'ils décident d'arrêter.[1]
L'aggravation de l'emphysème sous-cutané peut être associée à une malposition d'un drain thoracique, c'est pourquoi un repositionnement avec un nouveau drain thoracique est recommandé. Une sonde thoracique ne doit jamais être réinsérée car cela peut augmenter le risque d'empyème pour le patient.[1]
Notes
Références
- Cette page a été modifiée ou créée le 2020/11/09 à partir de Iatrogenic Pneumothorax (StatPearls / Iatrogenic Pneumothorax (2020/08/10)), écrite par les contributeurs de StatPearls et partagée sous la licence CC-BY 4.0 international (jusqu'au 2022-12-08). Le contenu original est disponible à https://www.ncbi.nlm.nih.gov/pubmed/30252313 (livre).
- Cette page a été modifiée ou créée le 2020/11/09 à partir de Pneumothorax (StatPearls / Pneumothorax (2020/08/11)), écrite par les contributeurs de StatPearls et partagée sous la licence CC-BY 4.0 international (jusqu'au 2022-12-08). Le contenu original est disponible à https://www.ncbi.nlm.nih.gov/pubmed/28722915 (livre).
- Cette page a été modifiée ou créée le 2020/11/09 à partir de Spontaneous Pneumothorax (StatPearls / Spontaneous Pneumothorax (2020/07/26)), écrite par les contributeurs de StatPearls et partagée sous la licence CC-BY 4.0 international (jusqu'au 2022-12-08). Le contenu original est disponible à https://www.ncbi.nlm.nih.gov/pubmed/29083723 (livre).
- Cette page a été modifiée ou créée le 2020/11/09 à partir de Acute Pneumothorax Evaluation and Treatment (StatPearls / Acute Pneumothorax Evaluation and Treatment (2020/08/12)), écrite par les contributeurs de StatPearls et partagée sous la licence CC-BY 4.0 international (jusqu'au 2022-12-08). Le contenu original est disponible à https://www.ncbi.nlm.nih.gov/pubmed/30855900 (livre).
- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 1,11 1,12 1,13 1,14 1,15 1,16 1,17 1,18 1,19 1,20 1,21 1,22 1,23 1,24 1,25 1,26 1,27 1,28 1,29 1,30 1,31 1,32 1,33 1,34 1,35 1,36 1,37 1,38 1,39 1,40 1,41 1,42 1,43 1,44 1,45 1,46 1,47 1,48 1,49 1,50 1,51 1,52 1,53 1,54 1,55 1,56 1,57 1,58 et 1,59 Catherine L. McKnight et Bracken Burns, StatPearls, StatPearls Publishing, (PMID 28722915, lire en ligne)
- ↑ L. J. Melton, N. G. Hepper et K. P. Offord, « Incidence of spontaneous pneumothorax in Olmsted County, Minnesota: 1950 to 1974 », The American Review of Respiratory Disease, vol. 120, no 6, , p. 1379–1382 (ISSN 0003-0805, PMID 517861, DOI 10.1164/arrd.1979.120.6.1379, lire en ligne)
- ↑ B. Celik, E. Sahin, A. Nadir et M. Kaptanoglu, « Iatrogenic pneumothorax: etiology, incidence and risk factors », The Thoracic and Cardiovascular Surgeon, vol. 57, no 5, , p. 286–290 (ISSN 1439-1902, PMID 19629891, DOI 10.1055/s-0029-1185365, lire en ligne)
- ↑ 4,0 4,1 et 4,2 Muhammad A. Baig, Muhammad B. Majeed, Bashar M. Attar et Zubair Khan, « Efficacy and Safety of Indwelling Pleural Catheters in Management of Hepatic Hydrothorax: A Systematic Review of Literature », Cureus, vol. 10, no 8, , e3110 (ISSN 2168-8184, PMID 30338185, Central PMCID 6175258, DOI 10.7759/cureus.3110, lire en ligne)
- ↑ 5,0 5,1 5,2 5,3 5,4 5,5 et 5,6 Jafet A. Ojeda Rodriguez et John E. Hipskind, StatPearls, StatPearls Publishing, (PMID 30252313, lire en ligne)
- ↑ Andrea Loiselle, James M. Parish, James A. Wilkens et Dawn E. Jaroszewski, « Managing iatrogenic pneumothorax and chest tubes », Journal of Hospital Medicine, vol. 8, no 7, , p. 402–408 (ISSN 1553-5606, PMID 23765922, DOI 10.1002/jhm.2053, lire en ligne)
- ↑ 7,00 7,01 7,02 7,03 7,04 7,05 7,06 7,07 7,08 7,09 7,10 7,11 7,12 7,13 7,14 7,15 7,16 7,17 7,18 7,19 7,20 7,21 7,22 7,23 7,24 7,25 7,26 7,27 7,28 7,29 7,30 7,31 7,32 7,33 7,34 7,35 7,36 7,37 7,38 7,39 7,40 et 7,41 M Henry, T Arnold et J Harvey, « BTS guidelines for the management of spontaneous pneumothorax », Thorax, vol. 58, no Suppl 2, , ii39–ii52 (ISSN 0040-6376, PMID 12728149, Central PMCID 1766020, DOI 10.1136/thorax.58.suppl_2.ii39, lire en ligne)
- ↑ 8,00 8,01 8,02 8,03 8,04 8,05 8,06 8,07 8,08 8,09 8,10 et 8,11 John Costumbrado et Sassan Ghassemzadeh, StatPearls, StatPearls Publishing, (PMID 29083723, lire en ligne)
- ↑ 9,0 9,1 9,2 9,3 9,4 9,5 9,6 et 9,7 Chad G. Ball, Andrew W. Kirkpatrick et David V. Feliciano, « The occult pneumothorax: what have we learned? », Canadian Journal of Surgery. Journal Canadien De Chirurgie, vol. 52, no 5, , E173–179 (ISSN 1488-2310, PMID 19865549, Central PMCID 2769131, lire en ligne)
- ↑ Steven P. Walker, Anna C. Bibby, Paul Halford et Louise Stadon, « Recurrence rates in primary spontaneous pneumothorax: a systematic review and meta-analysis », The European Respiratory Journal, vol. 52, no 3, (ISSN 1399-3003, PMID 30002105, DOI 10.1183/13993003.00864-2018, lire en ligne)
- ↑ Luca Bertolaccini, Maria Teresa Congedo, Alessandro Bertani et Piergiorgio Solli, « A project to assess the quality of the published guidelines for managing primary spontaneous pneumothorax from the Italian Society of Thoracic Surgeons », European Journal of Cardio-Thoracic Surgery: Official Journal of the European Association for Cardio-Thoracic Surgery, vol. 54, no 5, 11 01, 2018, p. 920–925 (ISSN 1873-734X, PMID 29788194, DOI 10.1093/ejcts/ezy199, lire en ligne)
- ↑ D. Gupta, A. Hansell, T. Nichols et T. Duong, « Epidemiology of pneumothorax in England », Thorax, vol. 55, no 8, , p. 666–671 (ISSN 0040-6376, PMID 10899243, Central PMCID 1745823, DOI 10.1136/thorax.55.8.666, lire en ligne)
- ↑ 13,0 et 13,1 Lisa Shieh, Minjoung Go, Daniel Gessner et Jonathan H. Chen, « Improving and sustaining a reduction in iatrogenic pneumothorax through a multifaceted quality-improvement approach », Journal of Hospital Medicine, vol. 10, no 9, , p. 599–607 (ISSN 1553-5606, PMID 26041246, Central PMCID 5548000, DOI 10.1002/jhm.2388, lire en ligne)
- ↑ 14,0 14,1 et 14,2 Michael J. Kilbourne, Grant V. Bochicchio, Thomas Scalea et Yan Xiao, « Avoiding common technical errors in subclavian central venous catheter placement », Journal of the American College of Surgeons, vol. 208, no 1, , p. 104–109 (ISSN 1879-1190, PMID 19228511, DOI 10.1016/j.jamcollsurg.2008.09.025, lire en ligne)
- ↑ Sunil Kumar Garg, Pragya Garg, Nidhi Anchan et Ashish Jaiswal, « Iatrogenic Bilateral Simultaneous Pneumothorax: Call for Vigilance », Indian Journal of Critical Care Medicine: Peer-Reviewed, Official Publication of Indian Society of Critical Care Medicine, vol. 21, no 9, , p. 607–609 (ISSN 0972-5229, PMID 28970663, Central PMCID 5613615, DOI 10.4103/ijccm.IJCCM_108_17, lire en ligne)
- ↑ Alberto A. Arteaga, Kristen D. Pitts et Andrea F. Lewis, « Iatrogenic pneumothorax during hypoglossal nerve stimulator implantation », American Journal of Otolaryngology, vol. 39, no 5, , p. 636–638 (ISSN 1532-818X, PMID 29941192, DOI 10.1016/j.amjoto.2018.06.014, lire en ligne)
- ↑ Rumi Tagami, Takashi Moriya, Kosaku Kinoshita et Katsuhisa Tanjoh, « Bilateral tension pneumothorax related to acupuncture », Acupuncture in Medicine: Journal of the British Medical Acupuncture Society, vol. 31, no 2, , p. 242–244 (ISSN 1759-9873, PMID 23449179, DOI 10.1136/acupmed-2012-010284, lire en ligne)
- ↑ 18,0 18,1 18,2 et 18,3 M. Swierzy, M. Helmig, M. Ismail et J. Rückert, « [Pneumothorax] », Zentralblatt Fur Chirurgie, vol. 139 Suppl 1, , S69–86; quiz S87 (ISSN 1438-9592, PMID 25264729, DOI 10.1055/s-0034-1383029, lire en ligne)
- ↑ 19,0 et 19,1 Hugh Scott, « Le pneumothorax, à qui de s'en occuper? », Le Médecin du Québec, (lire en ligne)
- ↑ 20,0 20,1 20,2 20,3 et 20,4 Jafet A. Ojeda Rodriguez et John E. Hipskind, StatPearls, StatPearls Publishing, (PMID 30252313, lire en ligne)
- ↑ Keegan Tupchong, « Update: Is Needle Aspiration Better Than Chest Tube Placement for the Management of Primary Spontaneous Pneumothorax? », Annals of Emergency Medicine, vol. 72, no 1, , e1–e2 (ISSN 1097-6760, PMID 29615265, DOI 10.1016/j.annemergmed.2018.02.025, lire en ligne)
- ↑ 22,0 22,1 22,2 22,3 et 22,4 Jost Schnell, Meinrad Beer, Stephan Eggeling et Wolfgang Gesierich, « Management of Spontaneous Pneumothorax and Post-Interventional Pneumothorax: German S3 Guideline », Respiration; International Review of Thoracic Diseases, vol. 97, no 4, , p. 370–402 (ISSN 1423-0356, PMID 30041191, DOI 10.1159/000490179, lire en ligne)
- ↑ 23,0 23,1 23,2 23,3 et 23,4 Amy Wong, Elena Galiabovitch et Krishna Bhagwat, « Management of primary spontaneous pneumothorax: a review », ANZ journal of surgery, vol. 89, no 4, , p. 303–308 (ISSN 1445-2197, PMID 29974615, DOI 10.1111/ans.14713, lire en ligne)
- ↑ 24,0 24,1 24,2 24,3 et 24,4 Conceição Santos, Saurabh Gupta, Melissa Baraket et Peter J. Collett, « Outcomes of an initiative to improve inpatient safety of small bore thoracostomy tube insertion », Internal Medicine Journal, vol. 49, no 5, , p. 644–649 (ISSN 1445-5994, PMID 30230151, Central PMCID 6851751, DOI 10.1111/imj.14110, lire en ligne)
- ↑ 25,00 25,01 25,02 25,03 25,04 25,05 25,06 25,07 25,08 25,09 25,10 25,11 25,12 25,13 25,14 et 25,15 John Costumbrado et Sassan Ghassemzadeh, StatPearls, StatPearls Publishing, (PMID 29083723, lire en ligne)
- ↑ H. Drinhaus, T. Annecke et J. Hinkelbein, « [Chest decompression in emergency medicine and intensive care] », Der Anaesthesist, vol. 65, no 10, , p. 768–775 (ISSN 1432-055X, PMID 27629501, DOI 10.1007/s00101-016-0219-7, lire en ligne)
- ↑ 27,0 et 27,1 Chengdi Wang, Mengyuan Lyu, Jian Zhou et Yang Liu, « Chest tube drainage versus needle aspiration for primary spontaneous pneumothorax: which is better? », Journal of Thoracic Disease, vol. 9, no 10, , p. 4027–4038 (ISSN 2072-1439, PMID 29268413, Central PMCID 5723764, DOI 10.21037/jtd.2017.08.140, lire en ligne)
- ↑ Derek J. Roberts, Simon Leigh-Smith, Peter D. Faris et Christopher Blackmore, « Clinical Presentation of Patients With Tension Pneumothorax: A Systematic Review », Annals of Surgery, vol. 261, no 6, , p. 1068–1078 (ISSN 1528-1140, PMID 25563887, DOI 10.1097/SLA.0000000000001073, lire en ligne)
- ↑ 29,0 et 29,1 Mark Slade, « Management of pneumothorax and prolonged air leak », Seminars in Respiratory and Critical Care Medicine, vol. 35, no 6, , p. 706–714 (ISSN 1098-9048, PMID 25463161, DOI 10.1055/s-0034-1395502, lire en ligne)
- ↑ 30,0 et 30,1 David Zonies, Joel Elterman, Christopher Burns et Vincent Paul, « Trauma patients are safe to fly 72 hours after tube thoracostomy removal », The Journal of Trauma and Acute Care Surgery, vol. 85, no 3, , p. 491–494 (ISSN 2163-0763, PMID 29782482, DOI 10.1097/TA.0000000000001976, lire en ligne)
