Cancer de la vésicule biliaire
| Classe de maladie | |||
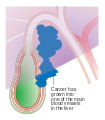
 Cancer de la vésicule biliaire (flèche noire) | |||
| Caractéristiques | |||
|---|---|---|---|
| Signes | Ascite, Hépatomégalie, Masse abdominale, Obstruction de l'intestin grêle, Lymphadénopathie (approche clinique), Nodule ombilicale, Nodule de soeur-marie-joseph, Carcinomatose | ||
| Symptômes |
Anorexie , Nausées, Contact infectieux, Sueurs nocturnes, Fatigue , Douleur abdominale, Asymptomatique , Prurit cutané , Vomissement , Perte de poids , ... [+] | ||
| Étiologies |
Cause idiopathique | ||
| Informations | |||
| Terme anglais | Gallbladder Cancer | ||
| Autres noms | Cancer vésiculaire | ||
| Wikidata ID | Q977787 | ||
| SNOMED CT ID | 363353009 | ||
| Spécialités | Chirurgie générale, Gastro-entérologie, Oncologie | ||
| |||
Le cancer de la vésicule biliaire est une néoplasie rare, mais souvent fatale. Il s'agit d'une tumeur agressive avec une présentation souvent tardive. Le cancer de la vésicule biliaire ne représente que 3 à 4% des cancers digestifs. Il reste de mauvais pronostic et peu étudié du fait de sa rareté.
Classification
Les différents sous-types de cancer de la vésicule biliaire sont [1][2][3]:
- l'adénocarcinome (90 %) biliaire ou intestinal
- le carcinome mucineux
- le carcinome à cellules claires
- le carcinome à cellules en bague à chaton
- le carcinome hépatoïde
- le carcinosarcome
- le carcinome épidermoïde
- le carcinome indifférencié
- le carcinome adénosquameux
- le cholangiocarcinome
- le mélanome
- le lymphome
- les tumeurs carcinoïdes (+ rares)
- les tumeurs neuroendocrines.
Les cellules cancéreuses peuvent être :
- bien différenciées
- modérément différenciées
- peu différenciées ou indifférenciées
Les sous-types histologiques de l'adénocarcinome sont [note 1]:
- infiltratif (au-delà de sous-séreux)
- nodulaire (envahissement adjacent précoce, rebords définis)
- papillaire (meilleur pronostic s'il est polypoïde, dans la lumière et peu envahissant)
- nodulo-infiltratif ou papillo-infiltratif
Épidémiologie
L'incidence du cancer de la vésicule biliaire dépend essentiellement de la localisation géographique. Il est plus élevé dans les populations asiatiques et d'Amérique latine (ex. le Chili, l'Inde, le Pakistan, la Corée, le Japon et Israël) en raison de la forte prévalence de calculs biliaires et d'infections chroniques de la vésicule biliaire dans ces régions. L'American Cancer Society estime 11 740 nouveaux cas de cancer de la vésicule biliaire et 3 830 décès aux États-Unis avec une prépondérance féminine en 2017. L'incidence globale du cancer de la vésicule biliaire a diminué chez les patients de plus de 50 ans, mais a augmenté dans la population plus jeune. Le cancer de la vésicule biliaire est plus fréquent chez les Caucasiens, les Autochtones du Sud-Ouest et les Américains hispaniques et moins fréquent chez les Afro-Américains. L'incidence des femmes qui développent cette néoplasie est 3 à 6 fois plus grande que celle des hommes. [3][4]
Étiologies
Les étiologies de cette maladie ne sont pas bien définies encore : rares sont les articles qui proposent des causes soutenues par des preuves solides. Parmi celles proposées, certains suggèrent l'implication des facteurs menstruels et reproductifs ou des hormones féminines étant donné la forte incidence chez les femmes, mais d'autres études sont nécessaires. [4]
Physiopathologie
Il existe quelques hypothèses pour expliquer le développement du cancer de la vésicule biliaire, mais elles ne sont pas encore bien comprises et définies.
Parmi celles-ci, on croit que une des mutations seraient les responsables en s'accumulant et en conduisant à un transformation maligne. L'inflammation semble être à l'origine de ces mutations. L'inflammation peut être causée par la présence de cholélithiase(s) et/ou d'agents pathogènes infectieux. La carcinogenèse des lithiases vésiculaires pourrait résulter de traumatismes itératifs et de l'irritation chronique. Cependant, des dérivés carcinogènes des acides biliaires peuvent également jouer un rôle. Les mutations les plus fréquemment décrites sont les oncogènes K-ras et les suppresseurs de tumeurs bêta-caténine (CTNNB1). La recherche n'a révélé aucun risque familial héréditaire. [5]
D'autres recherches pointent du doigt le phénomène de reflux pancréatico-biliaire. Effectivement, celui-ci survient lorsqu'une anomalie est présente au niveau de la jonction des voies biliaire et pancréatique. Le conduit commun qui relie le cholédoque et le canal de Wirsung serait particulièrement long, menant à une jonction hors de la paroi duodénale. Cela augmenterait la résistances dans les canaux pancréatiques et biliaires, réduirait ainsi le débit des sécrétions, mènerait à un reflux des sucs pancréatiques vers les voies biliaires et annulerait l'effet régulateur du sphincter d'Oddi. Il en résulterait une inflammation chronique de l'endothélium biliaire menant à une érosion et une régénération de la membrane endothéliale. Ce renouvellement cellulaire favoriserait une dysplasie et une transformation maligne. Finalement, la stagnation et la concentration de la bile dans la vésicule biliaire exacerberaient les effets cancérigènes, donc le cancer de la vésicule biliaire serait le site le plus fréquent de survenue de cancer par ce mécanisme.[6][7][8]
En ce qui a trait à l''adénocarcinome spécifiquement, celle-ci évolue de la dysplasie pré-néoplasique au carcinome in situ et, finalement, au cancer invasif, après environ 15 ans d'inflammation.
Présentation clinique
Facteurs de risque
Les facteurs de risque de cette maladie sont [3][4][9][10] :
- les facteurs non modifiables :
- l'âge
- le sexe féminin
- les mutations génétiques (ex. K-ras, CTNNB1)
- l'ethnicité
- une maladie auto-immune :
- les habitudes de vie :
- l'inflammation chronique est le facteur de risque le plus critique causé par :
- les agents cancérogènes (ex. la méthyldopa, l'isoniazide)
- l'exposition au travail (ex. la méthylcellulose, le radon, les métaux lourds)
- le diabète sucré
- la vésicule biliaire en porcelaine (entre 0% et 6% d'association)[14][15][16][note 3].
Questionnaire
Les patients atteints d'un cancer de la vésicule biliaire sont souvent asymptomatiques ou décrivent des symptômes vagues. Les symptômes de cette maladie sont [3][17]:
- des douleurs abdominales (souvent au quadrant supérieur droit)
- des nausées et des vomissements
- s'il y a obstruction secondaire des voies biliaires :
- de la fatigue, de l'anorexie, une perte de poids, une perte d'appétit et des sueurs nocturnes
- un malaise général.
D'ailleurs, les patient ayant fait un passage dans les zones endémiques ou ayant eu un contact infectieux avec Salmonella (ex. typhi et parathyphi) ou Helicobacter bilis sont à risque.
Examen clinique
L'examen clinique permet d'objectiver les signes suivants [18] :
- à l'examen abdominal :
- l'hépatomégalie
- la masse abdominale palpable
- l'ascite
- l'occlusion intestinale (indique un stade métastatique avancé)
- un nodule ombilicale (ex. nodule de soeur-marie-joseph, carcinomatose).
- à l'examen ganglionnaire, on recherche des adénopathies sus-claviculaires gauches.
Examens paracliniques
Laboratoires
Les analyses sanguines suivantes sont utiles pour le diagnostic de cette maladie [10][19][20] :
- une FSC, les ions, la créatininémie et la calcémie
- les marqueurs tumoraux CEA[Se: 79,4 %][Sp: 79,2 %] et CA 19-9[Se: 50 %][Sp: 92,7 %] sont fréquemment élevés, mais considérés comme non diagnostiques en raison du manque de spécificité et de sensibilité ; cependant, ces marqueurs sont utiles pour surveiller la réponse au traitement
- un bilan hépatique pour évaluer s'il y a un tableau choléstatique ou hépatocellulaire sous-jacent (ex. obstruction du cholédoque, virus de l'hépatite B ou C, maladies auto-immunes, etc.).
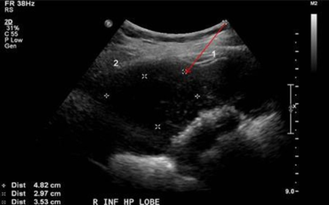
Imagerie
Les imageries suivantes peuvent être demandées lorsqu'on suspecte un cancer de la vésicule biliaire [3][10][19][20].
- L'échographie endoscopique transabdominale permet une description précise du stade du cancer, de la profondeur de l'invasion, de la lymphadénopathie locale de voir s'il y a de l'ascite.
- La tomodensitométrie thoracoabdominopelvienne est utile pour détecter les extensions de la pathologie au foie, aux ganglions lymphatiques ou la présence de métastases. Avec une précision jusqu'à 93%, on peut déterminer si la vésicule biliaire est résécable avant toute opération.
- La cholangio-IRM (MRCP) permet d'évaluer l'étendue de la maladie et d'identifier les candidats non résécables présentant une invasion du ligament hépatoduodénal, un enrobage vasculaire et/ou une atteinte des ganglions lymphatiques (sensibilité et spécificité proche de 100%).
- La TEP par tomodensitométrie (PET/CT) peut distinguer le caractère malin ou bénin de la tumeur et identifier une maladie occulte à un stade avancé afin d'éviter une intervention chirurgicale inutile.
- Si la résécabilité est douteuse à l'imagerie, une laparoscopie diagnostique permet d'évaluer l'étendue de la lésion, d'identifier des régions atteintes manquées (ou sous-estimées) à l'imagerie et déterminer officiellement de la résécabilité et curabilité opératoire.[21] Les imageries ont tendance à sous-estimer l'atteinte vasculaire et la carcinomatose, ce qui n'est pas le cas de la laparoscopie diagnostique. Si en cours de laparoscopie diagnostique le chirurgien s'aperçoit que la lésion est résécable, on transforme la laparoscopie diagnostique en laparoscopie thérapeutique.
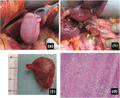
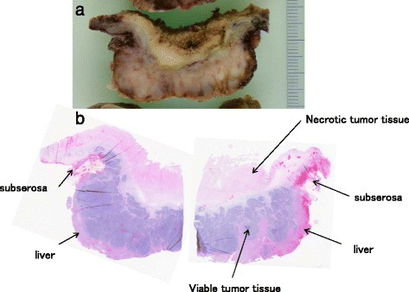
Histopathologie
À l'histologie, les facteurs de risque qu'un polype soit malin sont :
- > 1cm
- < 3 polypes
- le polype est sessile
- il y a un envahissement muqueux.
La localisation des cancers de la vésicule biliaire est à :
- 60% au fundus
- 30% au corps
- 10% au col.
Classification TNM
| Tumeur primaire (T) | ||
|---|---|---|
| TX | Impossible d'évaluer la tumeur | |
| T0 | Aucune évidence de tumeur primaire | |
| Tis | Carcinome in situ | |
| T1 | T1a | Envahissement de la lamina propria |
| T1b | Envahissement de la couche musculaire | |
| T2 | T2a | Envahissement du tissu conjonctif périmusculaire du côté péritonéal sans extension à la séreuse |
| T2b | Envahissement du tissu conjonctif périmusculaire du côté hépatique sans extension au foie | |
| T3 | Perforation de la séreuse (péritoine viscéral) et/ou envahissement direct du foie et/ou d'un autre organe ou d'une structure adjacent (ex. l'estomac, le duodénum, le côlon, le pancréas, l'épiploon, les voies biliaires extrahépatiques) | |
| T4 | Envahissement de la veine porte principale, ou de l'artère hépatique, ou de deux organes, ou ≥ 2 structures extrahépatiques | |
| Statut ganglionnaire (N) | ||
| NX | Impossible d'évaluer les ganglions | |
| N0 | Absence de métastase régionale | |
| N1 | Métastase au ganglion cystique, de la voie biliaire commune, de l'artère hépatique ou de la veine porte (ou 1 à 3 ganglions atteints) | |
| N2 | Métastase au ganglion périaortique, péricaval, AMS ou du tronc céliaque (ou ≥ 4 ganglions atteints) | |
| Métastases (M) | ||
| M0 | Absence de métastase | |
| M1 | Présence de métastases à distance | |
| Stades | ||
| Stade 0 | Tis + N0 + M0 | |
| Stade IA | T1a + N0 + M0 | |
| Stade IB | T1b + N0 + M0 | |
| Stade IIA | T2a + N0 + M0 | |
| Stade IIB | T2b + N0 + M0 | |
| Stade IIIA | T3 + N0 + M0 | |
| Stade IIIB | T1/T2/T3 + N1 + M0 | |
| Stade IVA | T4 + N0/N1 + M0 | |
| Stade IVB | N'importe quel T + N2 + M0 | |
| N'importe quel T + N'importe quel N + M1 | ||
-
Cancer de la vésicule biliaire (T1A et T1B)
-
Cancer de la vésicule biliaire (T2)
-
Cancer de la vésicule biliaire (T3)
-
Cancer de la vésicule biliaire (T4)
-
Cancer de la vésicule biliaire avec métastases ganglionnaires (T4, N1)
Il est important de noter que ce cancer progresse particulièrement à travers la vésicule biliaire, car sa paroi est dépourvue de muscularis mucosae et de sous-muqueuse. Ainsi, les cellules néoplasiques passent directement de la couche muqueuse à la musculeuse et la différence entre les types de tumeur primaire (T) ne correspondra pas à celle d'un autre organe (ex. colon). Le réseau lymphatique est également plus rapidement atteint pour un stade plus précoce.
Diagnostic différentiel
Le différentiel diagnostic de la maladie est [3][18] :
- une cholécystite alithiasique
- un carcinome de l'ampoule de Vater
- une sténose des voies biliaires
- une tumeur des voies biliaires
- une colique biliaire
- une cholédocholithiase
- une cholangite
- une cholécystite
- une vésicule de Courvoisier
- une vésicule porcelaine
- un hépatome
- un hémangiome
- un fibrome
- un lipome
- un polype inflammatoire de la vésicule biliaire
- des polypes de cholestérol
- une adénomyomatose de la vésicule biliaire.
Traitement
En général, l'objectif d'un cancer à un stade précoce est potentiellement curatif (résection chirurgicale suivie d'un traitement adjuvant). À l'inverse, le traitement de la maladie localement avancée et métastatique repose sur la chimiothérapie palliative.[3]
Le traitement pour la vésicule biliaire dépend de la manière dont la lésion a été découverte [23]:
- à l'imagerie
- à l'examen pathologique
- pendant une chirurgie.
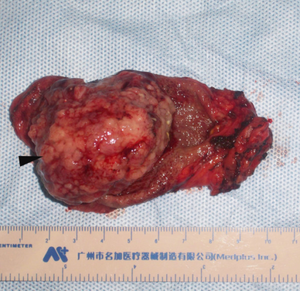
Si la lésion est symptomatique ou présente des signes de malignité, il est indiqué de procéder à une chirurgie ouverte avec un examen extemporané (marge sur le lit vésiculaire et sur le moignon cystique). On procèdera à une cholécystectomie incluant le lit vésiculaire. [21]
Le tableau ci-bas explique les différents scénarios diagnostiques et thérapeutiques en fonction de la méthode de découverte du cancer (pathologie, imagerie, pendant une chirurgie).
| Méthode de découverte | Stades | Résécabilité | Traitements |
|---|---|---|---|
| Pathologie | T1A | Oui |
|
| Ganglion du canal cystique atteint | Oui |
| |
| ≥ T1B
(si on découvre par hasard un cancer de stade ≥ T2 sur un spécimen de cholécystectomie, il est recommandé de revenir pour une exploration approfondie et une nouvelle résection) |
Oui |
| |
| Non résécable à l'imagerie |
| ||
| Imagerie | s/p | Oui |
|
| Non |
| ||
| Pendant une chirurgie | T1A | s/p |
|
| ≥ T1B
(Il est suggérer d'arrêter la chirurgie si l'évaluation de la résécabilité est impossible) |
Oui |
| |
| Non |
|
-
Résection avec hépatectomie segments IVb et V (chirurgie)
-
Adénocarcinome de la vésicule biliaire avec réaction de type sarcoïde dans les ganglions lymphatiques régionaux
-
Un foie bien perfusé après une résection des segments IVb/V, avec anastomose bilio-intestinale haute intrahilaire (flèche)
Chimiothérapie néoadjuvante
Le traitement néoadjuvant systémique consiste en une chimiothérapie avant l'intervention chirurgicale lorsque l'on doute de la résécabilité tumorale et que le patient est un bon candidat (peu de comorbidités).
Plusieurs options sont possibles [23]:
- le 5-fluorouracil avec de l'oxaliplatine
- de la capecitabine avec de l'oxaliplatine
- de la gemcitabine avec de la capecitabine
- de la gemcitabine avec de la cisplatine
- etc.
Comme le cancer de la vésicule biliaire est plus rare, les études sont moins définitives sur le traitement optimal. On utilise donc par inférence les protocoles de chimiothérapie néoadjuvante des tumeurs hépatiques et pancréatiques.
Chimiothérapie post-opératoire
Une chimiothérapie post-opératoire devrait être offerte dans les 8 à 12 semaines post-opératoires. Il faudra des analyses sanguines et une imagerie de re-staging avec le début du traitement. Un traitement adjuvant doit être proposé aux patients présentant un rapport d'échantillon pathologique réséqué de T2 ou supérieur, avec atteinte ganglionnaire et marge positive, de préférence pendant six mois de chimiothérapie adjuvante (ACT) ou alternative de quatre mois avec chimioradiothérapie adjuvante concomitante (ACRT)[3][24][25][26][27].
Chimiothérapie palliative
Les cancers de la vésicule biliaire localement avancés et métastatiques non résécables sont candidats à de chimiothérapie palliative. Un stade localement avancé peut être géré par radiothérapie externe et implique généralement un radiosensibilisateur, tel que le 5-FU, mais cette modalité permet rarement de contrôler la tumeur. Les patients aptes à la chimiothérapie pourraient envisager l'option de première ligne de gemcitabine [1 000 mg/m] plus cisplatine (cis) [25 mg/m] avec une toxicité acceptable[28]. D'autres combinaisons de chimiothérapie à base de gemcitabine peuvent être des alternatives.[29] Les patients avec une moins bonne classe fonctionnelle peuvent tenter ultimement la capécitabine avec une survie moindre. Tous les patients atteints d'une maladie avancée non résécable devraient se voir offrir de participer à des essais cliniques.
Suivi
Suite aux traitements, le suivi comprend un questionnaire, un examen physique assidu, des examens de laboratoire (tests de la fonction hépatique et des marqueurs tumoraux (CEA et CA19-9)) et une TDM thoraco-abdomino-pelvienne à chaque 3-6 mois pour une période de 2 ans. Les visites régulières peuvent être continuées pendant 3 années supplémentaires, et être changées pour des visites annuelles après 5 ans de suivi.[20] Toutes les autres investigations peuvent avoir lieu lorsqu'elles sont cliniquement indiquées. [3]
Complications
La principale complication de cette maladie est la récidive tumorale. Si le patient présente des douleurs abdominales, un ictère obstructif et une perte de poids significative, une récidive régionale avec atteinte intra-abdominale doit être suspectée.[3]
Évolution
La survie globale pour le cancer de la vésicule biliaire est généralement faible à cause du caractère agressif des tumeurs, de la présentation tardive, de la complexité de la position anatomique et du stade avancé au moment du diagnostic. Les taux de survie à 1 an et 5 ans ne dépassent pas les 20% en général.[30] La survie à 5 ans par stade est [10][31] :
- au stade 0 : 80%
- au stade I : 50%
- au stade II : 28%
- au stade IIIa : 8%
- au stade IIIb : 7%
- au stade IVa : 4%
- au stade IVb : 2%.
Les facteurs pronostiques pour cette maladie sont [3][10] :
- le stade TNM à l'investigation de départ
- la localisation spécifique de la tumeur
- l'opérabilité de la tumeur
- la réponse à la chimiothérapie
- la présence de jaunisse
- la propagation néoplasique.
De plus, le syndrome de Mirizzi (obstruction du canal hépatique commun par une pierre impactée dans le col de la vésicule biliaire due à une compression extrinsèque) a montré une association avec le cancer de la vésicule biliaire. Elle est de mauvais pronostic car non résécable à la présentation. [17]
Notes
- ↑ L'adénocarcinome ne provient pas d'un adénome comme on le voit habituellement dans les organes creux digestifs.
- ↑ Souvent causée par Salmonella (ex. typhi et parathyphi) et Helicobacter bilis
- ↑ La vésicule en porcelaine est une trouvaille occasionnelle à l'imagerie et elle était anciennement associée à un facteur de risque important du cancer de la vésicule biliaire. Cependant, plusieurs articles récents démontrent qu'elle représente un facteur de risque plutôt faible pour cette pathologie.
Références
- Cette page a été modifiée ou créée le 2023/01/26 à partir de Gallbladder Cancer (StatPearls / Gallbladder Cancer (2022/07/10)), écrite par les contributeurs de StatPearls et partagée sous la licence CC-BY 4.0 international (jusqu'au 2022-12-08). Le contenu original est disponible à https://www.ncbi.nlm.nih.gov/pubmed/28723031 (livre).
- Cet article a été créé en partie ou en totalité le 2023-02-12 à partir de Chirurgie (application), créée par Dre Hélène Milot, Dr Olivier Mailloux et collaborateurs et partagé sous la licence CC-BY-SA 4.0 international
- ↑ « Gallbladder carcinoma », sur www.pathologyoutlines.com (consulté le 18 mars 2023)
- ↑ « WHO classification », sur www.pathologyoutlines.com (consulté le 22 mars 2023)
- ↑ 3,00 3,01 3,02 3,03 3,04 3,05 3,06 3,07 3,08 3,09 3,10 et 3,11 Shiva Kumar R. Mukkamalla, Sarang Kashyap, Alejandro Recio-Boiles et Hani M. Babiker, StatPearls, StatPearls Publishing, (PMID 28723031, lire en ligne)
- ↑ 4,0 4,1 et 4,2 (en) Mikayla A. Schmidt, Lorena Marcano-Bonilla et Lewis R. Roberts, « Gallbladder cancer: epidemiology and genetic risk associations », Chinese Clinical Oncology, vol. 8, no 4, , p. 31–31 (ISSN 2304-3873 et 2304-3865, DOI 10.21037/cco.2019.08.13, lire en ligne)
- ↑ Amir A. Rahnemai-Azar, Allison Weisbrod, Mary Dillhoff et Carl Schmidt, « Intrahepatic cholangiocarcinoma: Molecular markers for diagnosis and prognosis », Surgical Oncology, vol. 26, no 2, , p. 125–137 (ISSN 1879-3320, PMID 28577718, DOI 10.1016/j.suronc.2016.12.009, lire en ligne)
- ↑ (en) Bertrand Le Roy, Johan Gagnière, Laura Filaire et Mikael Fontarensky, « Pancreaticobiliary maljunction and choledochal cysts: from embryogenesis to therapeutics aspects », Surgical and Radiologic Anatomy, vol. 38, no 9, , p. 1053–1060 (ISSN 0930-1038 et 1279-8517, DOI 10.1007/s00276-016-1669-y, lire en ligne)
- ↑ (en) Terumi Kamisawa, Hajime Anjiki, Naoto Egawa et Masanao Kurata, « Diagnosis and clinical implications of pancreatobiliary reflux », World Journal of Gastroenterology, vol. 14, no 43, , p. 6622 (ISSN 1007-9327, PMID 19034962, Central PMCID PMC2773301, DOI 10.3748/wjg.14.6622, lire en ligne)
- ↑ (en) Terumi Kamisawa, Masanao Kurata, Goro Honda et Kouji Tsuruta, « Biliopancreatic reflux—pathophysiology and clinical implications », Journal of Hepato-Biliary-Pancreatic Surgery, vol. 16, no 1, , p. 19–24 (ISSN 0944-1166 et 1436-0691, DOI 10.1007/s00534-008-0010-5, lire en ligne)
- ↑ I. Roa, J. C. Araya, M. Villaseca et X. De Aretxabala, « Preneoplastic lesions and gallbladder cancer: an estimate of the period required for progression », Gastroenterology, vol. 111, no 1, , p. 232–236 (ISSN 0016-5085, PMID 8698204, DOI 10.1053/gast.1996.v111.pm8698204, lire en ligne)
- ↑ 10,0 10,1 10,2 10,3 et 10,4 (en) Mislav Rakic, Leonardo Patrlj, Mario Kopljar et Robert Klicek, « Gallbladder cancer », Hepatobiliary Surgery and Nutrition, vol. 3, no 5, , p. 22126–22226 (ISSN 2304-389X et 2304-3881, PMID 25392833, Central PMCID PMC4207839, DOI 10.3978/j.issn.2304-3881.2014.09.03, lire en ligne)
- ↑ 10.21037/cco.2019.08.13
- ↑ 10.21037/cco.2019.08.13
- ↑ 10.21037/cco.2019.08.13
- ↑ Kimberly M. Brown, « Porcelain Gallbladder and Risk of Gallbladder Cancer », Archives of Surgery, vol. 146, no 10, , p. 1148 (ISSN 0004-0010, DOI 10.1001/archsurg.2011.258, lire en ligne)
- ↑ (en) Thomas Schnelldorfer, « Porcelain Gallbladder: A Benign Process or Concern for Malignancy? », Journal of Gastrointestinal Surgery, vol. 17, no 6, , p. 1161–1168 (ISSN 1091-255X et 1873-4626, DOI 10.1007/s11605-013-2170-0, lire en ligne)
- ↑ (en) Zarrish S. Khan, « Reassessing the Need for Prophylactic Surgery in Patients With Porcelain Gallbladder: Case Series and Systematic Review of the Literature », Archives of Surgery, vol. 146, no 10, , p. 1143 (ISSN 0004-0010, DOI 10.1001/archsurg.2011.257, lire en ligne)
- ↑ 17,0 et 17,1 Theegala L. V. D. Prasad, Ashok Kumar, Sadiq S. Sikora et Rajan Saxena, « Mirizzi syndrome and gallbladder cancer », Journal of Hepato-Biliary-Pancreatic Surgery, vol. 13, no 4, , p. 323–326 (ISSN 0944-1166, PMID 16858544, DOI 10.1007/s00534-005-1072-2, lire en ligne)
- ↑ 18,0 et 18,1 (en) Biliary Tract and Gallbladder Cancer: A Multidisciplinary Approach, Springer Berlin Heidelberg, coll. « Medical Radiology », (ISBN 978-3-642-40557-0 et 978-3-642-40558-7, DOI 10.1007/978-3-642-40558-7, lire en ligne)
- ↑ 19,0 et 19,1 Alessandro Furlan, James V. Ferris, Keyanoosh Hosseinzadeh et Amir A. Borhani, « Gallbladder carcinoma update: multimodality imaging evaluation, staging, and treatment options », AJR. American journal of roentgenology, vol. 191, no 5, , p. 1440–1447 (ISSN 1546-3141, PMID 18941083, DOI 10.2214/AJR.07.3599, lire en ligne)
- ↑ 20,0 20,1 20,2 et 20,3 (en) A. Vogel, J. Bridgewater, J. Edeline et R. K. Kelley, « Biliary tract cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up☆ », Annals of Oncology, vol. 34, no 2, , p. 127–140 (ISSN 0923-7534 et 1569-8041, PMID 36372281, DOI 10.1016/j.annonc.2022.10.506, lire en ligne)
- ↑ 21,0 21,1 et 21,2 (en) « Surgery for Gallbladder Cancer », sur www.cancer.org (consulté le 19 mars 2023)
- ↑ (en) « Gallbladder Cancer Stages », sur www.cancer.org (consulté le 18 mars 2023)
- ↑ 23,0 23,1 et 23,2 (en) « Gallbladder and Bile Duct Cancers » [PDF], sur nccn.org, (consulté le 19 mars 2023)
- ↑ 24,0 et 24,1 Al B. Benson, Michael I. D’Angelica, Daniel E. Abbott et Daniel A. Anaya, « Hepatobiliary Cancers, Version 2.2021, NCCN Clinical Practice Guidelines in Oncology », Journal of the National Comprehensive Cancer Network, vol. 19, no 5, , p. 541–565 (ISSN 1540-1405 et 1540-1413, DOI 10.6004/jnccn.2021.0022, lire en ligne)
- ↑ Edgar Ben-Josef, Katherine A. Guthrie, Anthony B. El-Khoueiry et Christopher L. Corless, « SWOG S0809: A Phase II Intergroup Trial of Adjuvant Capecitabine and Gemcitabine Followed by Radiotherapy and Concurrent Capecitabine in Extrahepatic Cholangiocarcinoma and Gallbladder Carcinoma », Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology, vol. 33, no 24, , p. 2617–2622 (ISSN 1527-7755, PMID 25964250, Central PMCID 4534524, DOI 10.1200/JCO.2014.60.2219, lire en ligne)
- ↑ John P. Neoptolemos, Malcolm J. Moore, Trevor F. Cox et Juan W. Valle, « Effect of adjuvant chemotherapy with fluorouracil plus folinic acid or gemcitabine vs observation on survival in patients with resected periampullary adenocarcinoma: the ESPAC-3 periampullary cancer randomized trial », JAMA, vol. 308, no 2, , p. 147–156 (ISSN 1538-3598, PMID 22782416, DOI 10.1001/jama.2012.7352, lire en ligne)
- ↑ « Capecitabine Extends Survival for Biliary Tract Cancer », Cancer Discovery, vol. 7, no 7, , OF1 (ISSN 2159-8290, PMID 28572460, DOI 10.1158/2159-8290.CD-NB2017-079, lire en ligne)
- ↑ Juan Valle, Harpreet Wasan, Daniel H. Palmer et David Cunningham, « Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer », The New England Journal of Medicine, vol. 362, no 14, , p. 1273–1281 (ISSN 1533-4406, PMID 20375404, DOI 10.1056/NEJMoa0908721, lire en ligne)
- ↑ Hanisah Guro, Jin Won Kim, YoungRok Choi et Jai Young Cho, « Multidisciplinary management of intrahepatic cholangiocarcinoma: Current approaches », Surgical Oncology, vol. 26, no 2, , p. 146–152 (ISSN 1879-3320, PMID 28577720, DOI 10.1016/j.suronc.2017.03.001, lire en ligne)
- ↑ R. P. Kiran, N. Pokala et S. J. Dudrick, « Incidence pattern and survival for gallbladder cancer over three decades--an analysis of 10301 patients », Annals of Surgical Oncology, vol. 14, no 2, , p. 827–832 (ISSN 1068-9265, PMID 17109082, DOI 10.1245/s10434-006-9224-4, lire en ligne)
- ↑ « Survival statistics for gallbladder cancer » (consulté le 10 février 2023)