« Fibrose rétropéritonéale » : différence entre les versions
(→Complications : TVP du MI) |
|||
| (45 versions intermédiaires par 3 utilisateurs non affichées) | |||
| Ligne 1 : | Ligne 1 : | ||
{{Information maladie | {{Information maladie | ||
| page = {{FULLPAGENAME}} <!-- Ne pas supprimer --> | | page = {{FULLPAGENAME}} <!-- Ne pas supprimer --> | ||
| nom = {{SUBPAGENAME}} | | nom = {{SUBPAGENAME}} | ||
| acronyme = | | acronyme =FRP | ||
| image = | | image = | ||
| description_image = | | description_image = | ||
| wikidata_id = | | wikidata_id =Q28292960 | ||
| autres_noms = | | autres_noms =Maladie d'Ormond, Périurétérite | ||
| terme_anglais = | | terme_anglais = Retroperitoneal fibrosis, Ormond's disease, Periureteritis fibrosa, Sclerosing retroperitoneal granuloma | ||
| vidéo = | | vidéo = | ||
| son = | | son = | ||
| spécialités = | | spécialités =Médecine interne, Urologie, Rhumatologie, Chirurgie vasculaire | ||
| version_de_classe = 3 <!-- Ne modifier que si la structure de la page et ses propriétés sont conformes à celles définies par cette version de la classe. --> | | version_de_classe = 3 <!-- Ne modifier que si la structure de la page et ses propriétés sont conformes à celles définies par cette version de la classe. --> | ||
}} | |démo=0|révision_par_les_pairs=|révision_par_le_comité_éditorial=|littérature_à_jour_date=|révision_par_les_pairs_date=|révision_par_le_comité_éditorial_date=}} | ||
La fibrose rétropéritonéale (FRP) | La fibrose rétropéritonéale (FRP) est une maladie qui se caractérise par un '''processus inflammatoire et fibrotique chronique dans le rétropéritoine''' à départ de l''''aorte infra-rénale''' qui peut conduire à la compression des structures rétropéritonéales en cas de progression.<ref>{{Citation d'un article|langue=Anglais|auteur1=J K ORMOND|titre=Bilateral ureteral obstruction due to envelopment and compression by an inflammatory retroperitoneal process|périodique=The Journal of Urology|date=Juin 1948|issn=|lire en ligne=https://www.auajournals.org/doi/10.1016/S0022-5347%2817%2968146-1|pages=}}</ref> Les tissus inflammatoires englobent l'aorte infra-rénale et les vaisseaux iliaques. Ce processus fibrotique peut atteindre les '''uretères''' et d'autres structures abdominales, y compris la veine cave inférieure. | ||
== Épidémiologie == | == Épidémiologie == | ||
La FRP affecte le plus souvent les patients âgés de 40 à 60 ans. Une prédominance masculine est observée avec un ratio H : F estimé à environ 2: 1 ou 3: 1. L'incidence de la FRP est inconnue, mais est estimée à 1 pour 200 000 à 500 000 par an.<ref name=":0" /> | La FRP est une maladie relativement rare qui affecte le plus souvent les patients âgés de 40 à 60 ans. Une prédominance masculine est observée avec un ratio H : F estimé à environ 2:1 ou 3:1. L'incidence de la FRP est inconnue, mais est estimée à 1 pour 200 000 à 500 000 par an.<ref name=":0">{{Citation d'un article|langue=Anglais|auteur1=Joshua S. Engelsgjerd|titre=Retroperitoneal Fibrosis|périodique=StatPearls [Internet|date=Janvier 2020|issn=|lire en ligne=https://www.ncbi.nlm.nih.gov/pubmed/29494016|pages=}}</ref> Il n'y a pas de prédominance de race. | ||
== Étiologies == | == Étiologies == | ||
* {{Étiologie | nom = | {| class="wikitable" | ||
! | |||
* {{Étiologie | nom = Médicamenteuse}} : De nombreux médicaments ont été impliqués dans le développement | !Proportion | ||
* {{Étiologie | nom = | !Commentaires<ref name=":0" /> | ||
* {{Étiologie | nom = | |- | ||
* {{Étiologie | nom = Radiothérapie}} : principalement pour le séminome testiculaire, le | !Primaire | ||
* {{Étiologie | nom = | |70 % | ||
* | | | ||
* Primaire est synonyme d'{{Étiologie | nom = idiopathique}}. | |||
* Fait partie du spectre de la périaortite chronique, une vasculite à gros vaisseaux. <ref name=":0" /> | |||
|- | |||
!Secondaire | |||
|30 % | |||
| | |||
* {{Étiologie | nom = Médicamenteuse}} : De nombreux médicaments ont été impliqués dans le développement de la FRP. Des médicaments tels que le méthysergide et d'autres alcaloïdes de l'ergot sont le plus souvent associés à cette condition. Les autres médicaments impliqués sont les bêta-bloqueurs, la méthyldopa, l'hydralazine et les analgésiques. Les agents biologiques étanercept et infliximab ont également été identifiés comme des causes secondaires. Les médicaments sont généralement considérés comme des facteurs de risque. | |||
* Néoplasie : {{Étiologie | nom = lymphomes}}, {{Étiologie | nom = tumeurs carcinoïdes}}, {{Étiologie | nom = lymphomes hodgkiniens}} et {{Étiologie | nom = lymphomes non hodgkiniens|affichage=non hodgkiniens}}, {{Étiologie | nom = sarcomes}} | |||
* Infections : {{Étiologie | nom = tuberculose}}, {{Étiologie | nom = histoplasmose}}, {{Étiologie | nom = actinomycose}} | |||
* {{Étiologie | nom = Radiothérapie}} : principalement pour le séminome testiculaire, le rectum et le cancer du pancréas | |||
* Chirurgie : {{Étiologie | nom = chirurgie ganglionnaire périaortique}}, {{Étiologie | nom = chirurgie colorectale}}, {{Étiologie | nom = chirurgie urologique}} ou {{Étiologie | nom = chirurgie gynécologique pelvienne}} et {{Étiologie | nom = l'hémorragie rétropéritonéale}} | |||
* Rares : associé à une {{Étiologie | nom = amyloïdose}}, une {{Étiologie | nom = panniculite mésentérique}} et différentes formes d'{{Étiologie | nom = histiocytose}}, plus particulièrement la {{Étiologie | nom = maladie d'Erdheim-Chester}}<ref>{{Citation d'un article|langue=Anglais|auteur1=Hosaka N|titre=Amyloid A gastrointestinal amyloidosis associated with idiopathic retroperitoneal fibrosis. Report of a rare autopsy case and review of the literature.|périodique=Arch Pathol Lab Med|date=2003|issn=1543-2165|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/12741901/|pages=}}</ref><ref>{{Citation d'un article|langue=anglais|auteur1=Jendro MC|titre=Improvement of Erdheim-Chester disease in two patients by sequential treatment with vinblastine and mycophenolate mofetil|périodique=Clin Rheumatol|date=2004|issn=|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/14749985/|pages=}}</ref> | |||
|} | |||
== Physiopathologie == | == Physiopathologie == | ||
Une | Une pathogénèse est probablement multifactorielle et des facteurs environnementaux et génétiques contribuent à la susceptibilité à la maladie. | ||
L'hypothèse physiopathologique de la FRP idiopathique suggère qu'elle serait une manifestation d'une maladie auto-immune systémique. La FRP peut survenir comme une aortite primaire qui déclenche une réponse fibro-inflammatoire périaortique. Toutefois, la maladie peut également atteindre d'autres segments vasculaires tels que l'aorte thoracique et les artères mésentériques, ce qui confirme l'idée qu'il s'agit d'une maladie inflammatoire systémique primaire des | L'hypothèse physiopathologique de la FRP idiopathique suggère qu'elle serait une manifestation d'une maladie auto-immune systémique. La FRP peut survenir comme une aortite primaire qui déclenche une réponse fibro-inflammatoire périaortique. Toutefois, la maladie peut également atteindre d'autres segments vasculaires tels que l'aorte thoracique et les artères mésentériques, ce qui confirme l'idée qu'il s'agit d'une maladie inflammatoire systémique primaire des grands vaisseaux<ref>{{Citation d'un article|langue=Anglais|auteur1=Hamano H|titre=Hydronephrosis associated with retroperitoneal fibrosis and sclerosing pancreatitis|périodique=Lancet VOLUME 359, ISSUE 9315|date=2002|issn=|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/11978339/|pages=P1403-1404}}</ref>. Cette présentation multifocale est observée dans les formes idiopathiques liées ou non liées aux IgG-4, mais n'est pas retrouvée dans les cas de FRP secondaires. | ||
La condition est fréquemment associée à des concentrations accrues de | La condition est fréquemment associée à des concentrations accrues de protéines inflammatoires, d'auto-anticorps et de maladies auto-immunes connues. L'antigène ayant été identifié comme déclencheur de la réponse inflammatoire serait la céroïde, un polymère complexe de lipides oxydés et de protéines que l'on trouve dans les plaques athéroscléreuses. <ref name=":0" /> Les cellules présentatrices d'antigène présenteraient l'antigène aux lymphocytes T CD4+ qui se logent dans la paroi aortique et le rétropéritoine. Ceux-ci sécréteraient ensuite l'IL-6, qui joue un rôle dans l'activation des lymphocytes B et des fibroblastes. Les lymphocytes T CD4 + sécrètent également des cytokines Th2 qui conduisent à la prolifération et à la maturation des lymphocytes B en plasmocytes, et peuvent ainsi mener à une expansion préférentielle des plasmocytes producteurs d'IgG4<ref>{{Citation d'un article|langue=Anglais|auteur1=Ramshaw AL|titre=Cytokine gene expression in aortic adventitial inflammation associated with advanced atherosclerosis (chronic periaortitis)|périodique=J Clin Pathol|date=1994|issn=|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/7962625/|pages=}}</ref><ref>{{Citation d'un article|langue=Anglais|auteur1=Zen Y|titre=Th2 and regulatory immune reactions are increased in immunoglobin G4-related sclerosing pancreatitis and cholangitis|périodique=Hepatology|date=2007|issn=|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/17518371/|pages=}}</ref>. | ||
Sur le plan histologique, on note la présence de macrophages, de plasmocytes, de lymphocytes B et T. La plupart des plasmocytes sont positifs pour l'immunoglobuline 4 (IgG4). La présence de plasmocytes producteurs d'IgG4 suggère que le FRP pourrait également être une manifestation d'une maladie liée aux IgG4 (IgG4-RD). Il s'agit d'une maladie multisystémique caractérisée par par un infiltrat lymphoplasmocytaire enrichi en plasmocytes IgG4 positifs et avec degrés variables de fibrose. | Sur le plan histologique, on note la présence de macrophages, de plasmocytes, de lymphocytes B et T. La plupart des plasmocytes sont positifs pour l'immunoglobuline 4 (IgG4). La présence de plasmocytes producteurs d'IgG4 suggère que le FRP pourrait également être une manifestation d'une maladie liée aux IgG4 (IgG4-RD). Il s'agit d'une maladie multisystémique caractérisée par par un infiltrat lymphoplasmocytaire enrichi en plasmocytes IgG4 positifs et avec degrés variables de fibrose. | ||
La physiopathologie exacte de la FRP d'origine médicamenteuse reste incertaine <ref name=":3">{{Citation d'un article|langue=Anglais|auteur1=Augusto Vaglio|titre=Retroperitoneal fibrosis|périodique=Lancet|date=Janvier 21, 2006|issn=|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/16427494/|pages=P241-251}}</ref><ref name=":4">{{Citation d'un article|langue=Anglais|auteur1=D A Breems|titre=The role of advanced atherosclerosis in idiopathic retroperitoneal fibrosis. Analysis of nine cases|périodique=Neth J Med|date=Février 2000|issn=|lire en ligne=https://www.ncbi.nlm.nih.gov/pubmed/10710938|pages=}}</ref><ref name=":5">{{Citation d'un article|langue=Anglais|auteur1=Paul J Scheel Jr|titre=Retroperitoneal fibrosis: the clinical, laboratory, and radiographic presentation|périodique=Medicine (Baltimore)|date=2009|issn=|lire en ligne=https://www.ncbi.nlm.nih.gov/pubmed/19593224|pages=}}</ref><ref name=":6">{{Citation d'un article|langue=Anglais|auteur1=G A Barbalias|titre=Idiopathic retroperitoneal fibrosis revisited|périodique=Int Urol Nephrol|date=1999|issn=|lire en ligne=https://www.ncbi.nlm.nih.gov/pubmed/10668935|pages=}}</ref>. | La physiopathologie exacte de la FRP d'origine médicamenteuse reste incertaine <ref name=":3">{{Citation d'un article|langue=Anglais|auteur1=Augusto Vaglio|titre=Retroperitoneal fibrosis|périodique=Lancet|date=Janvier 21, 2006|issn=|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/16427494/|pages=P241-251}}</ref><ref name=":4">{{Citation d'un article|langue=Anglais|auteur1=D A Breems|titre=The role of advanced atherosclerosis in idiopathic retroperitoneal fibrosis. Analysis of nine cases|périodique=Neth J Med|date=Février 2000|issn=|lire en ligne=https://www.ncbi.nlm.nih.gov/pubmed/10710938|pages=}}</ref><ref name=":5">{{Citation d'un article|langue=Anglais|auteur1=Paul J Scheel Jr|titre=Retroperitoneal fibrosis: the clinical, laboratory, and radiographic presentation|périodique=Medicine (Baltimore)|date=2009|issn=|lire en ligne=https://www.ncbi.nlm.nih.gov/pubmed/19593224|pages=}}</ref><ref name=":6">{{Citation d'un article|langue=Anglais|auteur1=G A Barbalias|titre=Idiopathic retroperitoneal fibrosis revisited|périodique=Int Urol Nephrol|date=1999|issn=|lire en ligne=https://www.ncbi.nlm.nih.gov/pubmed/10668935|pages=}}</ref>. | ||
== Présentation clinique == | == Présentation clinique == | ||
=== Facteurs de risque === | === Facteurs de risque === | ||
* | Les facteurs de risque sont : | ||
* | * l'{{Facteur de risque|nom=exposition à l'amiante|RR=|référence_RR=|RC (OR)=}} et le {{Facteur de risque|nom=tabagisme|RR=|référence_RR=|RC (OR)=}} : | ||
** la combinaison du tabagisme et de l'exposition à l'amiante est associée à un risque de FRP multiplié par 8 à 12 fois alors qu'une exposition a l'un de ces facteurs de risque est associée à un risque multiplié par 3 à 4 fois <ref>{{Citation d'un article|langue=Anglais|auteur1=Massimo Nesti|titre=Malignant mesothelioma in Italy, 1997|périodique=Am J Ind Med|date=Janvier 2004|issn=|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/14691969/|pages=}}</ref> | |||
* l'{{Facteur de risque|nom=athérosclérose|RR=|référence_RR=|RC (OR)=}} | |||
* certains médicaments | |||
** le {{Facteur de risque|nom=méthysergide|RR=|référence_RR=|RC (OR)=}} et d'autres {{Facteur de risque|nom=alcaloïdes de l'ergot|RR=|référence_RR=|RC (OR)=}} | |||
** les {{Facteur de risque|nom=bêta-bloqueurs|RR=|référence_RR=|RC (OR)=}} | |||
** la {{Facteur de risque|nom=méthyldopa|RR=|référence_RR=|RC (OR)=}} | |||
** l'{{Facteur de risque|nom=hydralazine|RR=|référence_RR=|RC (OR)=}} | |||
** les {{Facteur de risque|nom=analgésiques|RR=|référence_RR=|RC (OR)=}} | |||
** les {{Facteur de risque|nom=agents biologiques|RR=|référence_RR=|RC (OR)=}} ({{Facteur de risque|nom=étanercept|RR=|référence_RR=|RC (OR)=}} et {{Facteur de risque|nom=infliximab|RR=|référence_RR=|RC (OR)=}}). | |||
=== Questionnaire === | === Questionnaire === | ||
Les symptômes | Les symptômes comprennent généralement : | ||
* {{Symptôme | nom = | * la {{Symptôme | nom = douleur lombaire|affichage=|prévalence=90}} | ||
* {{Symptôme | nom = | ** il s'agit d'une douleur sourde, sans coliques, inchangée avec la position et avec irradiation dans l'aine et/ou au niveau de l'hypogastre | ||
* {{Symptôme | nom = | ** c'est une douleur qui répond de manière transitoire aux anti-inflammatoires non stéroïdiens <ref name=":13">{{Citation d'un article|langue=Anglais|auteur1=Augusto Vaglio|titre=Idiopathic Retroperitoneal Fibrosis|périodique=Journal of the American Society of Nephrology|date=2016|issn=1533-3450|lire en ligne=https://jasn.asnjournals.org/content/27/7/1880#F1|pages=}}</ref> <ref name=":2">{{Citation d'un article|langue=Anglais|auteur1=Augusto Vaglio|titre=Retroperitoneal fibrosis: new insights into clinical presentation and diagnosis|périodique=Medicine (Baltimore)|date=2009|issn=|lire en ligne=https://www.ncbi.nlm.nih.gov/pubmed/19593225|pages=}}</ref> | ||
* {{Symptôme | nom = | * la {{Symptôme | nom = douleur testiculaire|affichage=|prévalence=50}} <ref name=":7">{{Citation d'un article|langue=Anglais|auteur1=H Schulte-Baukloh|titre=Scrotal involvement with idiopathic retroperitoneal fibrosis|périodique=Journal of Urology|date=1999|issn=|lire en ligne=https://www.ncbi.nlm.nih.gov/pubmed/10524906|pages=}}</ref> | ||
* {{Symptôme | nom = | * la {{Symptôme | nom = nausée|affichage=|prévalence=}} | ||
* {{Symptôme | nom = | * l'{{Symptôme | nom = anorexie|affichage=|prévalence=}} | ||
* {{Symptôme | nom = | * la {{Symptôme | nom = fatigue|affichage=|prévalence=60}} | ||
* {{Symptôme | nom = | * la {{Symptôme | nom = perte de poids|affichage=|prévalence=54}} | ||
* l'{{Symptôme | nom = oligurie|affichage=|prévalence=}} et l'{{Symptôme | nom = anurie|affichage=|prévalence=}}<ref group="note">La masse de fibrose rétropéritonéale est centrée autour de l'aorte distale entre L4 et L5 et entoure les uretères. Cela peut conduire à une hydronéphrose par compression extrinsèque sur les uretères conduisant à une interférence avec le péristaltisme urétéral.</ref> | |||
* la {{Symptôme | nom = claudication vasculaire aux membres inférieurs|affichage=|prévalence=}}<ref group="note">Le patient peut également décrire une claudication du haut de la jambe liée à une atteinte artérielle des membres inférieurs ou des symptômes d’ischémie mésentérique due à une compression des artères mésentériques</ref> <ref name=":3" /><ref name=":8">{{Citation d'un article|langue=Anglais|auteur1=L R Baker|titre=Idiopathic retroperitoneal fibrosis. A retrospective analysis of 60 cases|périodique=British Journal of Urology|date=1987|issn=|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/3427331/|pages=}}</ref><ref name=":2" /><ref name=":9">{{Citation d'un article|langue=Anglais|auteur1=Kevin Day|titre=Retroperitoneal fibrosis|périodique=Journal of Urology|date=2012|issn=|lire en ligne=https://www.ncbi.nlm.nih.gov/pubmed/22341276|pages=}}</ref>.<ref name=":0" /> | |||
À noter que la présentation clinique de la FRP idiopathique est variable et peut complexifier le diagnostic, car cette condition peut faire partie du spectre des maladies liées aux IgG4 et survient souvent chez des patients atteints d'autres maladies auto-immunes <ref name=":13" /> | |||
=== Examen clinique === | === Examen clinique === | ||
* {{Examen clinique | nom = | À l'examen physique, les éléments suivants sont à rechercher<ref name=":0" /> : | ||
* {{Examen clinique | nom = | * aux {{Examen clinique|nom=signes vitaux|indication=}} : l'{{Signe | nom = hypertension artérielle|affichage=|prévalence=57}}<ref group="note">en raison d'une atteinte de l'artère rénale</ref> | ||
* {{Examen clinique | nom = | * à l'{{Examen clinique|nom=examen abdominal|indication=}} : une {{Signe | nom = sensibilité de l'angle costovertébral|affichage=|prévalence=}} | ||
* à l'{{Examen clinique|nom=examen des membres inférieurs|indication=}} <ref group="note">La veine cave inférieure peut également être obstruée en raison d'une compression extrinsèque de la masse entraînant une thrombose veineuse profonde et un œdème des membres inférieurs.</ref>: | |||
** l'{{Signe | nom = oedème des membres inférieurs|affichage=|prévalence=}} | |||
** des {{Signe | nom = thrombophlébite profonde|affichage=signes de thrombophlébite profonde|prévalence=}} (6-14%) | |||
* à l'{{Examen clinique|nom=examen des testicules|indication=}} : {{Signe | nom = hydrocèle|affichage=|prévalence=}}, {{Signe | nom = sensibilité testiculaire|affichage=|prévalence=}}, {{Signe clinique|nom=varicocèle|affichage=|prévalence=}}<ref group="note">Par compression des veines gonadiques</ref>. | |||
== Examens paracliniques == | == Examens paracliniques == | ||
{{ | === Analyses de laboratoire === | ||
Aucune anomalie hématologique ou biochimique n'est spécifique à la FRP<ref name=":0" />. Cependant, les laboratoires suivants peuvent être obtenus <ref name=":0" /><ref name=":1" />: | |||
* {{ | * une {{Signe paraclinique | nom = anémie|prévalence=45|Se=|référence_Se=|Sp=|référence_Sp=|VPP=|référence_VPP=|VPN=|référence_VPN=|PLR=|référence_PLR=|NLR=}} à la {{Examen paraclinique|nom=FSC|indication=}}<ref name=":1" /> <ref group="note">Probablement liée à une insuffisance rénale et à une inflammation chronique</ref> | ||
* | * un {{Examen paraclinique|nom=créatininémie|indication=}} {{Signe paraclinique | nom = Créatitinémie augmentée|prévalence=50-75|Se=|référence_Se=|Sp=|référence_Sp=|VPP=|référence_VPP=|VPN=|référence_VPN=|PLR=|référence_PLR=|NLR=|affichage=augmentée}}<ref name=":1">{{Citation d'un ouvrage|nom1=Ferri, Fred F.,|titre=Ferri's clinical advisor 2021|isbn=978-0-323-71334-4|isbn2=0-323-71334-3|oclc=1162353749|lire en ligne=https://www.worldcat.org/oclc/1162353749|consulté le=2021-01-05}}</ref><ref group="note">Peut être observée en fonction de la présence et de l'étendue de l'obstruction urétérale ([[insuffisance rénale post-rénale]])</ref> | ||
* une {{Examen paraclinique|nom=vitesse de sédimentation|indication=}} {{Signe paraclinique | nom = Vitesse de sédimentation augmentée|prévalence=|Se=|référence_Se=|Sp=|référence_Sp=|VPP=|référence_VPP=|VPN=|référence_VPN=|PLR=|référence_PLR=|NLR=|affichage=augmentée}} et une {{Examen paraclinique|nom=protéine C réactive|indication=}} <ref group="note">Ils sont généralement élevées au moment du diagnostic et peuvent être utiles pour surveiller la réponse au traitement</ref> | |||
* les {{Examen paraclinique|nom=immunoglobulines sériques|indication=}}, y compris les {{Examen paraclinique|nom=IgG4|indication=}} | |||
* une {{Examen paraclinique|nom=TSH|indication=}} {{Signe paraclinique | nom = TSH basse|prévalence=25|Se=|référence_Se=|Sp=|référence_Sp=|VPP=|référence_VPP=|VPN=|référence_VPN=|PLR=|référence_PLR=|NLR=|affichage=basse}}<ref name=":14" /> | |||
* des dosages d'auto-anticorps, tels que les {{Examen paraclinique|nom=anticorps antinucléaires|indication=}}, les {{Examen paraclinique|nom=microsomes anti-thyroïdiens|indication=}}, les {{Examen paraclinique|nom=anti-thyroglobulines|indication=}}, les {{Examen paraclinique|nom=anticorps cytoplasmiques anti-neutrophiles|indication=}} ou les {{Examen paraclinique|nom=anticorps anti-muscles lisses|indication=}} | |||
* une {{Examen paraclinique|nom=électrophorèse des protéines sériques|indication=}} et {{Examen paraclinique|nom=analyse des chaînes légères sériques|indication=}} <ref name=":3" />. | |||
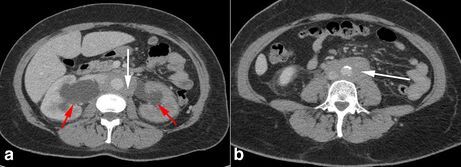
[[Fichier:Fibroseretro.jpg|vignette|461x461px|FRP vue au CT en phase portale : hydronéphrose bilatérale (flèche rouge) ; tissus de haute densité en périaortique (flèche blanche)]] | |||
=== Imagerie === | |||
* {{Investigation | nom = Échographie rénale | indication = Indication}} : révèle souvent une {{Signe paraclinique | nom = masse périaortique|prévalence=|Se=|référence_Se=|Sp=|référence_Sp=|VPP=|référence_VPP=|VPN=|référence_VPN=|PLR=|référence_PLR=|NLR=}} mal définie qui est typiquement hypoéchogène et peut être associée à une [[hydronéphrose]] <ref name=":3" />. | |||
* {{Investigation | nom = Tomodensitométrie avec contraste | indication = Indication}} (examen de choix) : permet de visualiser l'étendue de la FRP, la présence d'une lymphadénopathie et d'une tumeur. La masse est généralement confluente et englobe les côtés antérieur et latéraux de l'aorte, encerclant et comprimant souvent la VCI. Les découvertes typiques incluent également l'{{Signe paraclinique | nom = hydronéphrose|prévalence=|Se=|référence_Se=|Sp=|référence_Sp=|VPP=|référence_VPP=|VPN=|référence_VPN=|PLR=|référence_PLR=|NLR=}} et la {{Signe paraclinique | nom = déviation médiale de l'uretère proximal et moyen|prévalence=|Se=|référence_Se=|Sp=|référence_Sp=|VPP=|référence_VPP=|VPN=|référence_VPN=|PLR=|référence_PLR=|NLR=}} et une {{Signe paraclinique | nom = dilatation de l'uretère|prévalence=|Se=|référence_Se=|Sp=|référence_Sp=|VPP=|référence_VPP=|VPN=|référence_VPN=|PLR=|référence_PLR=|NLR=}} en amont de l'obstruction. L'un des avantages de la tomodensitométrie est qu'elle permet la biopsie guidée par CT pour obtenir un spécimen histologique pour le diagnostic pathologique <ref name=":9" /><ref name=":10">{{Citation d'un article|langue=Anglais|auteur1=Carmel G Cronin|titre=Retroperitoneal fibrosis: a review of clinical features and imaging findings|périodique=AJR Am J Roentgenol|date=2008|issn=|lire en ligne=https://www.ncbi.nlm.nih.gov/pubmed/18647912|pages=}}</ref><ref name=":11">{{Citation d'un article|langue=Anglais|auteur1=L Dalla-Palma|titre=Computed tomography in the diagnosis of retroperitoneal fibrosis|périodique=Urology radiology|date=1981|issn=|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/7314324/|pages=}}</ref><ref name=":0" />. Trois phases sont possibles<ref name=":14" /> : | |||
** La phase artérielle permet de bien évaluer l'anatomie vasculaire, la présence d'anévrisme (classification différente). | |||
** La phase veineuse permet d'identifier des thromboses veineuses, des formations cavales, les collatérales le cas échéant. | |||
** La phase excrétoire permet de bien identifier les uretères, leur déplacement et leur engainement. | |||
* {{Investigation | nom = IRM | indication = Indication}} : la résonance magnétique démontre un signal de faible densité en pondération T1 et de degré variable en signal T2. Des cas secondaires à des néoplasies métastatiques sont souvent de densité hétérogène, globuleux et causent moins de déviation médiale des uretères<ref name=":1" />. L'extension de la fibrose au-delà des vaisseaux rénaux est davantage compatible avec un diagnostic de fibrose maligne<ref name=":14" />. | |||
* {{Investigation|nom=PET-CT|indication=}} : une tomodensitométrie au 18F-FDG permet d'identifier l'inflammation. La distribution multicentrique n'est pas en faveur de la FRP, mais pourrait être représentative d'une maladie à IgG-4, une néoplasie ou à la maladie d'Erdheim-Chester<ref name=":14" />. Cette modalité peut également être utile pour déterminer la réponse au traitement en mesurant l'index d'activité métabolique inflammatoire. | |||
* {{Investigation|nom=Scintigraphie Mag3-Lasix|indication=}} : examen utile pour déterminer le degré et la latéralité de l'atteinte rénale post-rénale obstructive<ref name=":14" />. | |||
=== Biopsie === | |||
Le rôle de la biopsie est controversé. Si une intervention chirurgicale est prévue pour le traitement de la compression des uretères et / ou de la VCI, une biopsie ouverte de la masse est recommandée. Une biopsie guidée par CT peut également être obtenue lors du bilan initial avant tout traitement. Un consensus d'experts '''suggère une biopsie''' de la masse dans les cas suivants <ref name=":0" />: | |||
* lorsque l'emplacement de la masse est atypique | |||
* lorsque les résultats cliniques et de laboratoire suggèrent la présence d'une infection sous-jacente ou d'une tumeur maligne | |||
* l'apparence volumineuse sur les études d'imagerie; extension au-dessus de l'origine des artères rénales ou déplacement antérieur de l'aorte | |||
* l'expérience locale avec FRP est limitée | |||
* l'absence de réponse au traitement initial <ref name=":0" />. | |||
=== Histopathologie === | |||
Sur le plan pathologique, l'aspect macroscopique de la FRP est celui d'une masse dense lisse, plate et de couleur beige qui entoure les structures rétropéritonéales, généralement centrées sur les quatrième et cinquième vertèbres lombaires avec invasion de l'uretère ou du muscle psoas. | |||
Sur le plan histologique, la FRP est concordante est la présentation d'un processus inflammatoire non spécifique et les trouvailles ne permettent pas de distinguer la forme idiopathique de la forme secondaire. Il existe une prolifération fibroblastique avec du collagène de type 1-alpha densément hyalinisé en faisceaux épais et irréguliers encerclant souvent de petits vaisseaux et des infiltrats chroniques variables. Les infiltrats sont composés de macrophages, de plasmocytes et de lymphocytes B et T <ref name=":3" /><ref name=":0" />. L'histologie de la paroi aortique représente des changements athérosclérotiques de l'intima avec une inflammation marquée de l'adventice aortique<ref name=":14" /><ref group="note">On ne biopsie pas sciemment l'aorte, on ne fait cette analyse que s'il y eu remplacement aortique ou en post-mortem sur une autopsie. </ref>. | |||
À l'immunohistochimie, les agrégats ont généralement un noyau riche en cellules B CD20 + et une périphérie riche en cellules T CD3, CD 4, et CD8+<ref name=":14" />. La plupart des plasmocytes sont positifs pour l'immunoglobuline G4 (IgG4) <ref name=":12">https://www.ncbi.nlm.nih.gov/pubmed/28070877</ref><ref name=":0" />. | |||
== Approche clinique == | == Approche clinique == | ||
La fibrose rétropéritonéale est souvent découverte fortuitement dans le bilan de l'obstruction des voies urinaires ou de l'insuffisance veineuse ou artérielle. En règle générale, une évaluation initiale du patient, un bilan de laboratoire est obtenu, ainsi qu'une échographie rénale initiale, si le patient présente des plaintes de douleur au flanc.<ref name=":0" /> Par ailleurs, on fait un bilan néoplasique approprié pour l'âge pour éliminer des causes secondaires<ref name=":1" />. | |||
== Diagnostic == | == Diagnostic == | ||
À noter qu'en l'absence de définition officielle et standardisée, la littérature à son sujet est limitée. Les sociétés savantes semblent toutefois s'entendre qu'actuellement, pour poser le diagnostic de fibrose rétropéritonéale, on doit avoir les '''3 critères suivants'''<ref name=":14">{{Citation d'un article|langue=en|prénom1=Paul J.|nom1=Scheel|prénom2=Nancy|nom2=Feeley|titre=Retroperitoneal Fibrosis|périodique=Rheumatic Disease Clinics of North America|volume=39|numéro=2|date=2013-05|doi=10.1016/j.rdc.2013.02.004|lire en ligne=https://linkinghub.elsevier.com/retrieve/pii/S0889857X13000057|consulté le=2021-01-04|pages=365–381}}</ref> : | |||
{{ | # des tissus de faible densité d'allure inflammatoire autour de l'aorte infra-rénale ou des vaisseaux iliaques à l'imagerie (CT ou IRM), il y a une extension caudale vers la bifurcation iliaque ; rarement le processus peut s'étendre jusqu'aux vaisseaux rénaux, mais jamais plus haut<ref name=":14" />. | ||
# absence de malignité à la biopsie | |||
# absence de maladie fibrosante systémique multicentrique (exemple : maladie à IgG-4, maladie de Erdheim-Chester). | |||
Un diagnostic définitif nécessite une biopsie tissulaire, bien qu'il soit controversé de savoir si une biopsie est nécessaire pour les patients avec des études d'imagerie non-équivoques démontrant des résultats caractéristiques de la FRP.<ref name=":0" /> | |||
== Diagnostic différentiel == | == Diagnostic différentiel == | ||
{| class="wikitable" | |||
{{ | ! | ||
* {{Diagnostic différentiel | nom = | !DDX | ||
* {{Diagnostic différentiel | nom = | !Explication | ||
* {{Diagnostic différentiel | nom = | |- | ||
* | ! rowspan="7" |Néoplasies | ||
|{{Diagnostic différentiel | nom = Lymphome rétropéritonéal}} | |||
| | |||
Maladie rétropéritonéale d'Erdheim-Chester | * La fibrose rétropéritonéale est centrée au niveau L4 à L5. Si les études d'imagerie montrent une masse centrée plus céphalique vers L4 à L5, un diagnostic de lymphome rétropéritonéal doit être considéré.<ref name=":0" /> | ||
|- | |||
|{{Diagnostic différentiel | nom = Tumeurs germinales}} | |||
| | |||
* Les tumeurs germinales extragonadales impliquant le médiastin et le rétropéritoine peuvent se présenter par une douleur abdominale sourde et montrer une masse rétropéritonéale à l'imagerie.<ref name=":0" /> | |||
|- | |||
|{{Diagnostic différentiel | nom = Sarcomes d'origine rétropéritonéale}} | |||
| | |||
* La présence d'une masse rétropéritonéale à l'imagerie doit évoquer le diagnostic différentiel des sarcomes d'origine rétropéritonéale.<ref name=":0" /> | |||
|- | |||
|{{Diagnostic différentiel | nom = Métastases rétropéritonéales}} | |||
| | |||
* La présence d'une masse rétropéritonéale à l'imagerie doit évoquer le diagnostic différentiel des métastases rétropéritonéales (exemple : cancer du sein lobulaire).<ref name=":0" /> | |||
|- | |||
|{{Diagnostic différentiel | nom = Fibromatose rétropéritonéale}} | |||
| | |||
* La présence de proliférations myo-fibroblastiques au niveau rétropéritonéale doit évoquer le diagnostic différentiel de la fibromatose rétropéritonéale ou tumeur desmoïde qui est une tumeur bénigne à agressivité locale pouvant causer une compression urétrale et mener à une insuffisance rénale. <ref>{{Citation d'un article|langue=Anglais|auteur1=M.S.Hamdi|titre=Insuffisance rénale révélant une fibromatose rétro-péritonéale|périodique=La Revue de Médecine interne|date=2018|issn=|lire en ligne=https://www.sciencedirect.com/science/article/pii/S0248866318303667#:~:text=D%C3%A9crite%20la%20premi%C3%A8re%20fois%20en,tort%20au%20diagnostic%20de%20fibrosarcome.|pages=}}</ref> | |||
|- | |||
|{{Diagnostic différentiel | nom = Pseudotumeur inflammatoire}} | |||
| | |||
* Malgré que la présentation soit plus souvent sous forme de nodules pulmonaires solitaires, la présence de masse rétropéritonéale doit évoquer le diagnostic de pseudotumeur inflammatoire ou de granulome plasmocytaire ayant une présentation invasive avec implication des ganglions rétropéritonéaux. <ref>{{Citation d'un article|langue=Anglais|auteur1=Emley TE|titre=Ureteropelvic junction obstruction due to inflammatory pseudotumor masquerading as hydronephrosis because of a neuropathic bladder in a child with myelomeningocele|périodique=Journal of Urology|date=2001|issn=|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/11445491/|pages=}}</ref><ref>{{Citation d'un article|langue=Anglais|auteur1=Stoeckle E|titre=Prognostic factors in retroperitoneal sarcoma: a multivariate analysis of a series of 165 patients of the French Cancer Center Federation Sarcoma Group|périodique=Cancer|date=2001|issn=|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/11466691/|pages=}}</ref> | |||
|- | |||
|{{Diagnostic différentiel | nom = Maladie d'Erdheim-Chester}} | |||
| | |||
* Une atteinte rétropéritonéale avec ou sans hydronéphrose peut être observée dans la maladie d'Erdheim-Chester. Il s'agit d'une maladie histiocytaire multisystémique rare à cellules non-Langerhans qui résulte d'une malignité des cellules progénitrices myéloïdes. Se manifeste le plus souvent par des lésions sclérotiques multifocales des os longs montrant des feuillets d'histiocytes mousseux à la biopsie, avec ou sans infiltration histiocytaire des tissus extra-osseux. | |||
|- | |||
!Maladie auto-immune | |||
|{{Diagnostic différentiel | nom = Maladie à IgG-4}} | |||
| | |||
* La maladie liée à l'immunoglobuline G4 est une affection fibro-inflammatoire à médiation immunitaire pouvant affecter plusieurs organes. La fibrose rétropéritonéale idiopathique est considérée par certains auteurs comme faisant partie du spectre des maladies liées aux IgG4. <ref name=":13" /> | |||
|- | |||
!Maladie athéromateuse | |||
|{{Diagnostic différentiel | nom = Anévrisme aortique inflammatoire}} | |||
| | |||
* La calcification d’origine athéromateuse de la crosse aortique caractéristique de l'anévrisme aortique inflammatoire (aorte de porcelaine) peut engendrer une fibrose péri-aortique. De la même manière que la fibrose rétro-péritonéale, cette condition peut se présenter cliniquement par des douleurs lombaires sourdes. C'est une manifestation peu connue de l'athérosclérose <ref>{{Citation d'un article|langue=Anglais|auteur1=J. Testart|titre=Anévrismes inflammatoires de l'aorte abdominale|périodique=Journal des Maladies Vasculaires|date=2000|issn=|lire en ligne=https://www.em-consulte.com/article/124521/anevrismes-inflammatoires-de-l-aorte-abdominale|pages=}}</ref> | |||
|} | |||
== Traitement == | == Traitement == | ||
Historiquement, le traitement de la FRP consistait à soulager l'obstruction urétérale de façon chirurgicale ou percutanée, mais maintenant nous optons davantage pour un traitement médical afin de contrôler la maladie. Plusieurs séries ont été publiées mettant de l'avant des traitements immunomodulateurs ou immunosuppresseurs pour faire régresser la maladie. Les buts du traitement sont de stopper la progression inflammatoire, renverser la fibrose et protéger les reins d'une obstruction chronique des uretères<ref name=":14" />. | |||
{| class="wikitable" | |||
! | |||
!Intervention | |||
!Explication<ref name=":0" /> | |||
|- | |||
! rowspan="3" |Gestion initiale | |||
|{{Traitement | nom = Néphrostomie percutanée|indication=|RRR=|RRA=|référence_RRR=|référence_RRA=}} ou {{Traitement | nom = endoprothèse urétérale|indication=|RRR=|RRA=|référence_RRR=|référence_RRA=}} | |||
| | |||
* Les patients présentant des signes de compression urétérale avec hydronéphrose et insuffisance rénale nécessitent une décompression urgente. | |||
* L'avantage de la mise en place d'un tuteur urétéral (double J) est la possibilité de réaliser des pyélographies rétrogrades au moment de l'intervention pour évaluer l'anatomie. | |||
* Chez les patients gravement malades présentant des anomalies électrolytiques et peu ou pas de débit urinaire, le placement d'un cathéter de néphrostomie est favorisé. | |||
* On doit changer les tumeurs aux trois mois, ils s'incrustent de cristaux de calcium et sont à risque d'infection<ref name=":14" />. | |||
|- | |||
|{{Traitement | nom = Remplacement liquidien|indication=|RRR=|RRA=|référence_RRR=|référence_RRA=}} et {{Traitement | nom = surveillance ingesta-excreta|indication=|RRR=|RRA=|référence_RRR=|référence_RRA=}} | |||
| | |||
* Après la décompression rénale, le patient doit être étroitement surveillé pour la '''[[Diurèse post-obstructive|diurèse post-obstructive]]''', l'état de la fonction rénale et le remplacement approprié des liquides et des électrolytes. | |||
|- | |||
|{{Traitement | nom = Arrêt de médication|indication=|RRR=|RRA=|référence_RRR=|référence_RRA=}} | |||
| | |||
* Tout médicament potentiellement contributoire doit être arrêté immédiatement. | |||
|- | |||
! rowspan="5" |Médical | |||
|{{Traitement | nom = Corticothérapie|indication=|RRR=|RRA=|référence_RRR=|référence_RRA=}} | |||
| | |||
* Elle permet la résolution de la douleur et des symptômes constitutionnels dans les jours suivant le début du traitement, une baisse rapide de la VS, une augmentation de l'hémoglobine et une amélioration de la diurèse s'il y avait une obstruction post-rénale.<ref name=":14" /> | |||
* Prednisone 1 mg/kg par jour X 4 semaines. Si une amélioration est observée, la dose est diminuée sur plusieurs mois à 10 mg / jour et maintenue pendant 6 à 18 mois supplémentaires. | |||
* Il a été démontré que la thérapie stéroïdienne chronique jusqu'à 2 ans permet une amélioration significative des symptômes cliniques et une régression de la masse rétropéritonéale. Le fait de ne pas détecter une amélioration clinique ou radiologique dans les 4 à 6 semaines suivant le début du traitement devrait entraîner une réévaluation par tomodensitométrie et une biopsie pour déterminer si le diagnostic de FRP est approprié. <ref>{{Citation d'un article|langue=Anglais|auteur1=Harreby M|titre=Retroperitoneal fibrosis treated with methylprednisolon pulse and disease-modifying antirheumatic drugs|périodique=Scand J Urol Nephrol|date=1994|issn=|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/7817165/|pages=}}</ref> | |||
* Taux de récidive après traitement : 11,8% (vs 18,2% pour le tamoxifène)<ref name=":18" /> | |||
|- | |||
|{{Traitement | nom = Mycophénolate mofétil|indication=|RRR=|RRA=|référence_RRR=|référence_RRA=}} | |||
| | |||
* MMF : interrompt la réponse des lymphocytes B et T et renverse la fibrose, diminue la production de collège type1 et augmente de le taux de collagénase<ref name=":14" /> | |||
* 1000 mg PO BID en même temps que les corticostéroïdes alors que l'on sèvre graduellement ces derniers. | |||
* On continue le mycophénolate mofétil jusqu'à ce que l'on puisse retirer les tuteurs urétéraux ou les cathéters de néphrostomie. On continue la médication jusqu'à 6 mois après le retrait du matériel urétéral et que l'on obtient une réduction de 25% de la masse périaortique<ref name=":1" />. | |||
* | |- | ||
|{{Traitement | nom = Tamoxifène|indication=|RRR=|RRA=|référence_RRR=|référence_RRA=}} | |||
| | |||
* | * Quoique moins efficace que les corticostéroïdes, le tamoxifène est un traitement alternatif<ref name=":1" /> . | ||
* Protocole proposé par Bommel et al. : 20 mg BID<ref>{{Citation d'un article|prénom1=E.F.H.|nom1=van Bommel|prénom2=L.G.|nom2=Pelkmans|prénom3=H.|nom3=van Damme|prénom4=T.R.|nom4=Hendriksz|titre=Long-term safety and efficacy of a tamoxifen-based treatment strategy for idiopathic retroperitoneal fibrosis|périodique=European Journal of Internal Medicine|volume=24|numéro=5|date=2013-07|issn=0953-6205|doi=10.1016/j.ejim.2012.11.010|lire en ligne=http://dx.doi.org/10.1016/j.ejim.2012.11.010|consulté le=2021-01-17|pages=444–450}}</ref> | |||
|- | |||
|{{Traitement | nom = Agents immunosuppresseurs|indication=|RRR=|RRA=|référence_RRR=|référence_RRA=}} | |||
| | |||
* Réservés aux cas réfractaires à la corticothérapie <ref name=":16">{{Citation d'un article|langue=Anglais|auteur1=Renzo Marcolongo|titre=Immunosuppressive therapy for idiopathic retroperitoneal fibrosis: a retrospective analysis of 26 cases|périodique=American Journal of Medicine|date=2004|issn=|lire en ligne=https://www.ncbi.nlm.nih.gov/pubmed/14749165|pages=}}</ref><ref name=":17">{{Citation d'un article|langue=Anglais|auteur1=Paul J Scheel Jr|titre=Combined prednisone and mycophenolate mofetil treatment for retroperitoneal fibrosis|périodique=Journal of Urology|date=2007|issn=|lire en ligne=https://www.ncbi.nlm.nih.gov/pubmed/17499287|pages=}}</ref><ref name=":18">{{Citation d'un article|langue=Anglais|auteur1=Augusto Vaglio|titre=Prednisone versus tamoxifen in patients with idiopathic retroperitoneal fibrosis: an open-label randomised controlled trial|périodique=Lancet|date=2011|issn=|lire en ligne=https://www.ncbi.nlm.nih.gov/pubmed/21733570|pages=}}</ref><ref name=":19">{{Citation d'un article|langue=Anglais|auteur1=D al-Musawi|titre=Idiopathic retroperitoneal fibrosis treated with tamoxifen only|périodique=British Journal of Urology|date=1998|issn=|lire en ligne=https://www.ncbi.nlm.nih.gov/pubmed/9772887|pages=}}</ref>.<ref name=":0" /> | |||
|- | |||
Traitement | |{{Traitement | nom = Rituximab|indication=|RRR=|RRA=|référence_RRR=|référence_RRA=}} | ||
| | |||
* Les thérapies biologiques telles que le Rituximab seraient des agents potentiellement efficaces dans les cas difficiles à traiter.<ref name=":13" /> | |||
|- | |||
!Traitement chirurgical | |||
|{{Examen paraclinique|nom=Urétérolyse|indication=}} | |||
Traitement chirurgical | | | ||
* Réservée aux scénarios suivants<ref name=":0" />: | |||
** Difficultés techniques ou complications avec d'autres manœuvres de soulagement des obstructions par techniques endoscopiques ou cytoscopiques | |||
** Absence de régression de masse après un traitement médical, avec compression persistante des uretères et autres structures | |||
** Résultats suggérant une malignité sous-jacente pour obtenir un diagnostic définitif <ref name=":0" />. | |||
* Difficultés techniques ou complications avec d'autres manœuvres de soulagement des obstructions | * La prise en charge chirurgicale peut être abordée avec une exploration ouverte, laparoscopique ou robotique et implique une '''urétérolyse''' et une manipulation des uretères pour éviter une obstruction récurrente. Les méthodes employées pour empêcher une obstruction urétérale récurrente comprennent l'enveloppement des uretères avec de la graisse omentale (épiploon) pour servir de barrière pour empêcher l'engainement par un tissu fibreux et favoriser la revascularisation, la transplantation d'urètre en position intrapéritonéale, ou la transposition des uretères latéralement, avec interposition de graisse rétropéritonéale entre uretères et tissu fibreux<ref name=":20">{{Citation d'un article|langue=Anglais|auteur1=O I Lindell|titre=Surgical treatment of ureteric obstruction in idiopathic retroperitoneal fibrosis|périodique=Scand J Urol Nephrol Suppl.|date=1988|issn=|lire en ligne=https://www.ncbi.nlm.nih.gov/pubmed/3187426|pages=}}</ref><ref name=":21">{{Citation d'un article|langue=Anglais|auteur1=Nicholas R Styn|titre=University of Michigan surgical experience with ureterolysis for retroperitoneal fibrosis: a comparison of laparoscopic and open surgical approaches|périodique=Journal of Urology|date=2011|issn=|lire en ligne=https://www.ncbi.nlm.nih.gov/pubmed/20510441|pages=}}</ref><ref name=":22">{{Citation d'un article|langue=Anglais|auteur1=M Carini|titre=Surgical treatment of retroperitoneal fibrosis with omentoplasty|périodique=Journal of Surgery|date=1982|issn=|lire en ligne=https://www.ncbi.nlm.nih.gov/pubmed/7058490|pages=}}</ref><ref name=":23">{{Citation d'un article|langue=Anglais|auteur1=David A Duchene|titre=Multi-institutional survey of laparoscopic ureterolysis for retroperitoneal fibrosis|périodique=Journal of Urology|date=2007|issn=|lire en ligne=https://www.ncbi.nlm.nih.gov/pubmed/17572177|pages=}}</ref>.<ref name=":0" /> | ||
* Absence de régression de masse après un traitement médical, avec | |} | ||
* Résultats suggérant une malignité sous-jacente pour obtenir un diagnostic définitif <ref name=":0" /> | |||
La prise en charge chirurgicale peut être abordée avec une exploration ouverte, laparoscopique ou robotique et implique une urétérolyse et une manipulation des uretères pour éviter une obstruction récurrente. Les méthodes employées pour empêcher une obstruction urétérale récurrente comprennent l'enveloppement des uretères avec de la graisse omentale pour servir de barrière pour empêcher l' | |||
== Suivi == | == Suivi == | ||
La surveillance de la réponse d’un patient au traitement nécessite un suivi étroit. Le patient doit être évalué cliniquement dans le mois suivant le début du traitement pour la résolution de la douleur et la résolution de l'obstruction urinaire. Après cela, le patient doit être surveillé cliniquement tous les 2 à 3 mois. Les cliniciens doivent obtenir la VS, la CRP, la créatinine et l'urée sériques une fois par mois pendant les trois premiers mois, puis tous les 2 à 3 mois. Un CT scan doit être réalisé un mois après le début du traitement, puis environ tous les 3 mois pour suivre la taille de la masse fibreuse. Après l'arrêt du traitement médical, il est recommandé de surveiller la rechute de la maladie en obtenant une échographie rénale, une VS, une CRP, une concentration de créatinine sérique tous les 3 à 6 mois et une imagerie tous les 6 mois pendant la première année, puis des tests de laboratoire tous les 6 à 12 mois. La surveillance doit être poursuivie indéfiniment.<ref name=":0" /> | |||
== Complications == | == Complications == | ||
La plupart des patients atteints de FRP demeureront asymptomatiques. Toutefois, en l'absence de traitement, certains patients évolueront défavorablement. Les complications sont secondaires à la compression des structures dans le rétropéritoine. Les plus fréquemment rapportées sont <ref name=":0" />: | |||
{{ | * l'{{Complication | nom = obstruction urétérale|RR=|référence_RR=|RC=}} (complication la plus fréquente)<ref group="note">Par compression urétrale</ref> | ||
* {{Complication | nom = | * l'{{Complication|nom=hypertension rénovasculaire|RR=|référence_RR=|RC=}}<ref group="note">Par compression des artères rénales</ref> | ||
* {{Complication | nom = Complication | * l'{{Complication | nom = insuffisance rénale chronique|RR=|référence_RR=|RC=}}<ref group="note">Secondaire à l'obstruction des uretères ou à la compression des artères rénales.</ref> | ||
* {{Complication | nom = | * la {{Complication | nom = compression de la veine cave inférieure|RR=|référence_RR=|RC=}} et la {{Complication|nom=compression des veines iliaques|RR=|référence_RR=|RC=}} qui peuvent mener à la survenue de complications indirectes telles que la {{Complication|nom=Thrombose veineuse profonde du membre inférieur|RR=|référence_RR=|RC=|affichage=TVP}}<ref group="note">Dans la plupart des cas, la compression de l'axe veineux est un processus graduel qui conduit à la formation d'une circulation veineuse collatérale.</ref> <ref>{{Citation d'un article|langue=Anglais|auteur1=Palmisano A|titre=Peri-renal collateral circles|périodique=Urology|date=2009|issn=|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/19476982/|pages=}}</ref> | ||
* ... | * la {{Complication|nom=compression des vaisseaux testiculaires rétropéritonéaux|RR=|référence_RR=|RC=}} <ref>{{Citation d'un article|langue=Anglais|auteur1=van Bommel EF|titre=Idiopathic retroperitoneal fibrosis: prospective evaluation of incidence and clinicoradiologic presentation|périodique=Medicine (Baltimore)|date=2009|issn=|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/19593223/|pages=}}</ref> | ||
* de rares cas d'{{Complication|nom=obstruction de l'intestin grêle|RR=|référence_RR=|RC=}} et d'{{Complication|nom=obstruction colique|RR=|référence_RR=|RC=}}<ref>{{Citation d'un article|langue=Anglais|auteur1=Faisal Aziz|titre=Retroperitoneal fibrosis: A rare cause of both ureteral and small bowel obstruction|périodique=World J Gastroenterol|date=2006|issn=|lire en ligne=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4087357/|pages=}}</ref><ref>{{Citation d'un article|langue=Anglais|auteur1=J G McCarthy|titre=Retroperitoneal fibrosis and large bowel obstruction: case report and review of the literature.|périodique=Ann Surg|date=1972|issn=|lire en ligne=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1355304/|pages=}}</ref>. | |||
== Évolution == | == Évolution == | ||
Dans la majorité des cas, les symptômes du patient commencent à s'améliorer rapidement après l'instauration du traitement. Après plusieurs semaines, l'imagerie par tomodensitométrie peut démontrer la résolution de la masse. La résolution complète des manifestations cliniques associées dépend du degré de gravité de la maladie et du degré de compression des structures rétropéritonéales. Si la prise en charge médicale n'est pas efficace dans le traitement de la masse, la thérapie chirurgicale peut contourner efficacement le tissu fibrotique et protéger les uretères.<ref name=":0" /> | |||
== Notes == | |||
<references group="note" /> | |||
= | |||
== Références == | == Références == | ||
{{Article importé d'une source | {{Article importé d'une source | ||
| accès = 2020/11/07 | | accès = 2020/11/07 | ||
| source = StatPearls | | source = StatPearls | ||
| version_outil_d'importation = 0.2a | | version_outil_d'importation = 0.2a | ||
| révisé = | | révisé = 1 | ||
| révision = 2020/09/12 | | révision = 2020/09/12 | ||
| pmid = 29494016 | | pmid = 29494016 | ||
| nom = Retroperitoneal Fibrosis | | nom = Retroperitoneal Fibrosis | ||
}} | |url=}} | ||
{{Article de l'application de chirurgie générale|date=2020/12/30}} | |||
<references /> | <references /> | ||
Version du 13 avril 2021 à 22:19
| Maladie | |
| Caractéristiques | |
|---|---|
| Signes | Varicocèle, Oedème des membres inférieurs, Hydrocèle, Sensibilité de l'angle costovertébral, Sensibilité testiculaire, Thrombose veineuse profonde du membre inférieur, Hypertension artérielle |
| Symptômes |
Anorexie , Oligurie, Anurie, Nausée, Fatigue , Claudication vasculaire aux membres inférieurs, Perte de poids , Lombalgie , Douleur testiculaire |
| Diagnostic différentiel |
Lymphome rétropéritonéal, Tumeurs germinales, Métastases rétropéritonéales, Fibromatose rétropéritonéale, Pseudotumeur inflammatoire, Sarcomes d'origine rétropéritonéale, Maladie d'Erdheim-Chester, Anévrisme aortique inflammatoire, Maladie à IgG-4 |
| Informations | |
| Terme anglais | Retroperitoneal fibrosis, Ormond's disease, Periureteritis fibrosa, Sclerosing retroperitoneal granuloma |
| Autres noms | Maladie d'Ormond, Périurétérite |
| Wikidata ID | Q28292960 |
| Spécialités | Médecine interne, Urologie, Rhumatologie, Chirurgie vasculaire |
|
| |
La fibrose rétropéritonéale (FRP) est une maladie qui se caractérise par un processus inflammatoire et fibrotique chronique dans le rétropéritoine à départ de l'aorte infra-rénale qui peut conduire à la compression des structures rétropéritonéales en cas de progression.[1] Les tissus inflammatoires englobent l'aorte infra-rénale et les vaisseaux iliaques. Ce processus fibrotique peut atteindre les uretères et d'autres structures abdominales, y compris la veine cave inférieure.
Épidémiologie
La FRP est une maladie relativement rare qui affecte le plus souvent les patients âgés de 40 à 60 ans. Une prédominance masculine est observée avec un ratio H : F estimé à environ 2:1 ou 3:1. L'incidence de la FRP est inconnue, mais est estimée à 1 pour 200 000 à 500 000 par an.[2] Il n'y a pas de prédominance de race.
Étiologies
| Proportion | Commentaires[2] | |
|---|---|---|
| Primaire | 70 % |
|
| Secondaire | 30 % |
|
Physiopathologie
Une pathogénèse est probablement multifactorielle et des facteurs environnementaux et génétiques contribuent à la susceptibilité à la maladie.
L'hypothèse physiopathologique de la FRP idiopathique suggère qu'elle serait une manifestation d'une maladie auto-immune systémique. La FRP peut survenir comme une aortite primaire qui déclenche une réponse fibro-inflammatoire périaortique. Toutefois, la maladie peut également atteindre d'autres segments vasculaires tels que l'aorte thoracique et les artères mésentériques, ce qui confirme l'idée qu'il s'agit d'une maladie inflammatoire systémique primaire des grands vaisseaux[5]. Cette présentation multifocale est observée dans les formes idiopathiques liées ou non liées aux IgG-4, mais n'est pas retrouvée dans les cas de FRP secondaires.
La condition est fréquemment associée à des concentrations accrues de protéines inflammatoires, d'auto-anticorps et de maladies auto-immunes connues. L'antigène ayant été identifié comme déclencheur de la réponse inflammatoire serait la céroïde, un polymère complexe de lipides oxydés et de protéines que l'on trouve dans les plaques athéroscléreuses. [2] Les cellules présentatrices d'antigène présenteraient l'antigène aux lymphocytes T CD4+ qui se logent dans la paroi aortique et le rétropéritoine. Ceux-ci sécréteraient ensuite l'IL-6, qui joue un rôle dans l'activation des lymphocytes B et des fibroblastes. Les lymphocytes T CD4 + sécrètent également des cytokines Th2 qui conduisent à la prolifération et à la maturation des lymphocytes B en plasmocytes, et peuvent ainsi mener à une expansion préférentielle des plasmocytes producteurs d'IgG4[6][7].
Sur le plan histologique, on note la présence de macrophages, de plasmocytes, de lymphocytes B et T. La plupart des plasmocytes sont positifs pour l'immunoglobuline 4 (IgG4). La présence de plasmocytes producteurs d'IgG4 suggère que le FRP pourrait également être une manifestation d'une maladie liée aux IgG4 (IgG4-RD). Il s'agit d'une maladie multisystémique caractérisée par par un infiltrat lymphoplasmocytaire enrichi en plasmocytes IgG4 positifs et avec degrés variables de fibrose.
La physiopathologie exacte de la FRP d'origine médicamenteuse reste incertaine [8][9][10][11].
Présentation clinique
Facteurs de risque
Les facteurs de risque sont :
- l'exposition à l'amiante et le tabagisme :
- la combinaison du tabagisme et de l'exposition à l'amiante est associée à un risque de FRP multiplié par 8 à 12 fois alors qu'une exposition a l'un de ces facteurs de risque est associée à un risque multiplié par 3 à 4 fois [12]
- l'athérosclérose
- certains médicaments
- le méthysergide et d'autres alcaloïdes de l'ergot
- les bêta-bloqueurs
- la méthyldopa
- l'hydralazine
- les analgésiques
- les agents biologiques (étanercept et infliximab).
Questionnaire
Les symptômes comprennent généralement :
- la douleur lombaire [Pr: 90 %]
- la douleur testiculaire [Pr: 50 %] [15]
- la nausée
- l'anorexie
- la fatigue [Pr: 60 %]
- la perte de poids [Pr: 54 %]
- l'oligurie et l'anurie[note 1]
- la claudication vasculaire aux membres inférieurs[note 2] [8][16][14][17].[2]
À noter que la présentation clinique de la FRP idiopathique est variable et peut complexifier le diagnostic, car cette condition peut faire partie du spectre des maladies liées aux IgG4 et survient souvent chez des patients atteints d'autres maladies auto-immunes [13]
Examen clinique
À l'examen physique, les éléments suivants sont à rechercher[2] :
- aux signes vitaux : l'hypertension artérielle [Pr: 57 %][note 3]
- à l'examen abdominal : une sensibilité de l'angle costovertébral
- à l'examen des membres inférieurs [note 4]:
- à l'examen des testicules : hydrocèle, sensibilité testiculaire, varicocèle[note 5].
Examens paracliniques
Analyses de laboratoire
Aucune anomalie hématologique ou biochimique n'est spécifique à la FRP[2]. Cependant, les laboratoires suivants peuvent être obtenus [2][18]:
- une anémie [Pr: 45 %] à la FSC[18] [note 6]
- un créatininémie augmentée [Pr: 50-75 %][18][note 7]
- une vitesse de sédimentation augmentée et une protéine C réactive [note 8]
- les immunoglobulines sériques, y compris les IgG4
- une TSH basse [Pr: 25 %][19]
- des dosages d'auto-anticorps, tels que les anticorps antinucléaires, les microsomes anti-thyroïdiens, les anti-thyroglobulines, les anticorps cytoplasmiques anti-neutrophiles ou les anticorps anti-muscles lisses
- une électrophorèse des protéines sériques et analyse des chaînes légères sériques [8].
Imagerie
- Échographie rénale : révèle souvent une masse périaortique mal définie qui est typiquement hypoéchogène et peut être associée à une hydronéphrose [8].
- Tomodensitométrie avec contraste (examen de choix) : permet de visualiser l'étendue de la FRP, la présence d'une lymphadénopathie et d'une tumeur. La masse est généralement confluente et englobe les côtés antérieur et latéraux de l'aorte, encerclant et comprimant souvent la VCI. Les découvertes typiques incluent également l'hydronéphrose et la déviation médiale de l'uretère proximal et moyen et une dilatation de l'uretère en amont de l'obstruction. L'un des avantages de la tomodensitométrie est qu'elle permet la biopsie guidée par CT pour obtenir un spécimen histologique pour le diagnostic pathologique [17][20][21][2]. Trois phases sont possibles[19] :
- La phase artérielle permet de bien évaluer l'anatomie vasculaire, la présence d'anévrisme (classification différente).
- La phase veineuse permet d'identifier des thromboses veineuses, des formations cavales, les collatérales le cas échéant.
- La phase excrétoire permet de bien identifier les uretères, leur déplacement et leur engainement.
- IRM : la résonance magnétique démontre un signal de faible densité en pondération T1 et de degré variable en signal T2. Des cas secondaires à des néoplasies métastatiques sont souvent de densité hétérogène, globuleux et causent moins de déviation médiale des uretères[18]. L'extension de la fibrose au-delà des vaisseaux rénaux est davantage compatible avec un diagnostic de fibrose maligne[19].
- PET-CT : une tomodensitométrie au 18F-FDG permet d'identifier l'inflammation. La distribution multicentrique n'est pas en faveur de la FRP, mais pourrait être représentative d'une maladie à IgG-4, une néoplasie ou à la maladie d'Erdheim-Chester[19]. Cette modalité peut également être utile pour déterminer la réponse au traitement en mesurant l'index d'activité métabolique inflammatoire.
- Scintigraphie Mag3-Lasix : examen utile pour déterminer le degré et la latéralité de l'atteinte rénale post-rénale obstructive[19].
Biopsie
Le rôle de la biopsie est controversé. Si une intervention chirurgicale est prévue pour le traitement de la compression des uretères et / ou de la VCI, une biopsie ouverte de la masse est recommandée. Une biopsie guidée par CT peut également être obtenue lors du bilan initial avant tout traitement. Un consensus d'experts suggère une biopsie de la masse dans les cas suivants [2]:
- lorsque l'emplacement de la masse est atypique
- lorsque les résultats cliniques et de laboratoire suggèrent la présence d'une infection sous-jacente ou d'une tumeur maligne
- l'apparence volumineuse sur les études d'imagerie; extension au-dessus de l'origine des artères rénales ou déplacement antérieur de l'aorte
- l'expérience locale avec FRP est limitée
- l'absence de réponse au traitement initial [2].
Histopathologie
Sur le plan pathologique, l'aspect macroscopique de la FRP est celui d'une masse dense lisse, plate et de couleur beige qui entoure les structures rétropéritonéales, généralement centrées sur les quatrième et cinquième vertèbres lombaires avec invasion de l'uretère ou du muscle psoas.
Sur le plan histologique, la FRP est concordante est la présentation d'un processus inflammatoire non spécifique et les trouvailles ne permettent pas de distinguer la forme idiopathique de la forme secondaire. Il existe une prolifération fibroblastique avec du collagène de type 1-alpha densément hyalinisé en faisceaux épais et irréguliers encerclant souvent de petits vaisseaux et des infiltrats chroniques variables. Les infiltrats sont composés de macrophages, de plasmocytes et de lymphocytes B et T [8][2]. L'histologie de la paroi aortique représente des changements athérosclérotiques de l'intima avec une inflammation marquée de l'adventice aortique[19][note 9].
À l'immunohistochimie, les agrégats ont généralement un noyau riche en cellules B CD20 + et une périphérie riche en cellules T CD3, CD 4, et CD8+[19]. La plupart des plasmocytes sont positifs pour l'immunoglobuline G4 (IgG4) [22][2].
Approche clinique
La fibrose rétropéritonéale est souvent découverte fortuitement dans le bilan de l'obstruction des voies urinaires ou de l'insuffisance veineuse ou artérielle. En règle générale, une évaluation initiale du patient, un bilan de laboratoire est obtenu, ainsi qu'une échographie rénale initiale, si le patient présente des plaintes de douleur au flanc.[2] Par ailleurs, on fait un bilan néoplasique approprié pour l'âge pour éliminer des causes secondaires[18].
Diagnostic
À noter qu'en l'absence de définition officielle et standardisée, la littérature à son sujet est limitée. Les sociétés savantes semblent toutefois s'entendre qu'actuellement, pour poser le diagnostic de fibrose rétropéritonéale, on doit avoir les 3 critères suivants[19] :
- des tissus de faible densité d'allure inflammatoire autour de l'aorte infra-rénale ou des vaisseaux iliaques à l'imagerie (CT ou IRM), il y a une extension caudale vers la bifurcation iliaque ; rarement le processus peut s'étendre jusqu'aux vaisseaux rénaux, mais jamais plus haut[19].
- absence de malignité à la biopsie
- absence de maladie fibrosante systémique multicentrique (exemple : maladie à IgG-4, maladie de Erdheim-Chester).
Un diagnostic définitif nécessite une biopsie tissulaire, bien qu'il soit controversé de savoir si une biopsie est nécessaire pour les patients avec des études d'imagerie non-équivoques démontrant des résultats caractéristiques de la FRP.[2]
Diagnostic différentiel
| DDX | Explication | |
|---|---|---|
| Néoplasies | Lymphome rétropéritonéal |
|
| Tumeurs germinales |
| |
| Sarcomes d'origine rétropéritonéale |
| |
| Métastases rétropéritonéales |
| |
| Fibromatose rétropéritonéale |
| |
| Pseudotumeur inflammatoire |
| |
| Maladie d'Erdheim-Chester |
| |
| Maladie auto-immune | Maladie à IgG-4 |
|
| Maladie athéromateuse | Anévrisme aortique inflammatoire |
|
Traitement
Historiquement, le traitement de la FRP consistait à soulager l'obstruction urétérale de façon chirurgicale ou percutanée, mais maintenant nous optons davantage pour un traitement médical afin de contrôler la maladie. Plusieurs séries ont été publiées mettant de l'avant des traitements immunomodulateurs ou immunosuppresseurs pour faire régresser la maladie. Les buts du traitement sont de stopper la progression inflammatoire, renverser la fibrose et protéger les reins d'une obstruction chronique des uretères[19].
| Intervention | Explication[2] | |
|---|---|---|
| Gestion initiale | néphrostomie percutanée ou endoprothèse urétérale |
|
| remplacement liquidien et surveillance ingesta-excreta |
| |
| arrêt de médication |
| |
| Médical | corticothérapie |
|
| mycophénolate mofétil |
| |
| tamoxifène | ||
| agents immunosuppresseurs | ||
| rituximab |
| |
| Traitement chirurgical | Urétérolyse |
|
Suivi
La surveillance de la réponse d’un patient au traitement nécessite un suivi étroit. Le patient doit être évalué cliniquement dans le mois suivant le début du traitement pour la résolution de la douleur et la résolution de l'obstruction urinaire. Après cela, le patient doit être surveillé cliniquement tous les 2 à 3 mois. Les cliniciens doivent obtenir la VS, la CRP, la créatinine et l'urée sériques une fois par mois pendant les trois premiers mois, puis tous les 2 à 3 mois. Un CT scan doit être réalisé un mois après le début du traitement, puis environ tous les 3 mois pour suivre la taille de la masse fibreuse. Après l'arrêt du traitement médical, il est recommandé de surveiller la rechute de la maladie en obtenant une échographie rénale, une VS, une CRP, une concentration de créatinine sérique tous les 3 à 6 mois et une imagerie tous les 6 mois pendant la première année, puis des tests de laboratoire tous les 6 à 12 mois. La surveillance doit être poursuivie indéfiniment.[2]
Complications
La plupart des patients atteints de FRP demeureront asymptomatiques. Toutefois, en l'absence de traitement, certains patients évolueront défavorablement. Les complications sont secondaires à la compression des structures dans le rétropéritoine. Les plus fréquemment rapportées sont [2]:
- l'obstruction urétérale (complication la plus fréquente)[note 10]
- l'hypertension rénovasculaire[note 11]
- l'insuffisance rénale chronique[note 12]
- la compression de la veine cave inférieure et la compression des veines iliaques qui peuvent mener à la survenue de complications indirectes telles que la TVP[note 13] [37]
- la compression des vaisseaux testiculaires rétropéritonéaux [38]
- de rares cas d'obstruction de l'intestin grêle et d'obstruction colique[39][40].
Évolution
Dans la majorité des cas, les symptômes du patient commencent à s'améliorer rapidement après l'instauration du traitement. Après plusieurs semaines, l'imagerie par tomodensitométrie peut démontrer la résolution de la masse. La résolution complète des manifestations cliniques associées dépend du degré de gravité de la maladie et du degré de compression des structures rétropéritonéales. Si la prise en charge médicale n'est pas efficace dans le traitement de la masse, la thérapie chirurgicale peut contourner efficacement le tissu fibrotique et protéger les uretères.[2]
Notes
- ↑ La masse de fibrose rétropéritonéale est centrée autour de l'aorte distale entre L4 et L5 et entoure les uretères. Cela peut conduire à une hydronéphrose par compression extrinsèque sur les uretères conduisant à une interférence avec le péristaltisme urétéral.
- ↑ Le patient peut également décrire une claudication du haut de la jambe liée à une atteinte artérielle des membres inférieurs ou des symptômes d’ischémie mésentérique due à une compression des artères mésentériques
- ↑ en raison d'une atteinte de l'artère rénale
- ↑ La veine cave inférieure peut également être obstruée en raison d'une compression extrinsèque de la masse entraînant une thrombose veineuse profonde et un œdème des membres inférieurs.
- ↑ Par compression des veines gonadiques
- ↑ Probablement liée à une insuffisance rénale et à une inflammation chronique
- ↑ Peut être observée en fonction de la présence et de l'étendue de l'obstruction urétérale (insuffisance rénale post-rénale)
- ↑ Ils sont généralement élevées au moment du diagnostic et peuvent être utiles pour surveiller la réponse au traitement
- ↑ On ne biopsie pas sciemment l'aorte, on ne fait cette analyse que s'il y eu remplacement aortique ou en post-mortem sur une autopsie.
- ↑ Par compression urétrale
- ↑ Par compression des artères rénales
- ↑ Secondaire à l'obstruction des uretères ou à la compression des artères rénales.
- ↑ Dans la plupart des cas, la compression de l'axe veineux est un processus graduel qui conduit à la formation d'une circulation veineuse collatérale.
Références
- Cette page a été modifiée ou créée le 2020/11/07 à partir de Retroperitoneal Fibrosis (StatPearls / Retroperitoneal Fibrosis (2020/09/12)), écrite par les contributeurs de StatPearls et partagée sous la licence CC-BY 4.0 international (jusqu'au 2022-12-08). Le contenu original est disponible à https://www.ncbi.nlm.nih.gov/pubmed/29494016 (livre).
- Cet article a été créé en partie ou en totalité le 2020/12/30 à partir de Chirurgie (application), créée par Dre Hélène Milot, Dr Olivier Mailloux et collaborateurs et partagé sous la licence CC-BY-SA 4.0 international
- ↑ (en) J K ORMOND, « Bilateral ureteral obstruction due to envelopment and compression by an inflammatory retroperitoneal process », The Journal of Urology, (lire en ligne)
- ↑ 2,00 2,01 2,02 2,03 2,04 2,05 2,06 2,07 2,08 2,09 2,10 2,11 2,12 2,13 2,14 2,15 2,16 2,17 2,18 2,19 2,20 2,21 2,22 2,23 2,24 2,25 et 2,26 (en) Joshua S. Engelsgjerd, « Retroperitoneal Fibrosis », StatPearls [Internet, (lire en ligne)
- ↑ (en) Hosaka N, « Amyloid A gastrointestinal amyloidosis associated with idiopathic retroperitoneal fibrosis. Report of a rare autopsy case and review of the literature. », Arch Pathol Lab Med, (ISSN 1543-2165, lire en ligne)
- ↑ (en) Jendro MC, « Improvement of Erdheim-Chester disease in two patients by sequential treatment with vinblastine and mycophenolate mofetil », Clin Rheumatol, (lire en ligne)
- ↑ (en) Hamano H, « Hydronephrosis associated with retroperitoneal fibrosis and sclerosing pancreatitis », Lancet VOLUME 359, ISSUE 9315, , P1403-1404 (lire en ligne)
- ↑ (en) Ramshaw AL, « Cytokine gene expression in aortic adventitial inflammation associated with advanced atherosclerosis (chronic periaortitis) », J Clin Pathol, (lire en ligne)
- ↑ (en) Zen Y, « Th2 and regulatory immune reactions are increased in immunoglobin G4-related sclerosing pancreatitis and cholangitis », Hepatology, (lire en ligne)
- ↑ 8,0 8,1 8,2 8,3 et 8,4 (en) Augusto Vaglio, « Retroperitoneal fibrosis », Lancet, , P241-251 (lire en ligne)
- ↑ (en) D A Breems, « The role of advanced atherosclerosis in idiopathic retroperitoneal fibrosis. Analysis of nine cases », Neth J Med, (lire en ligne)
- ↑ (en) Paul J Scheel Jr, « Retroperitoneal fibrosis: the clinical, laboratory, and radiographic presentation », Medicine (Baltimore), (lire en ligne)
- ↑ (en) G A Barbalias, « Idiopathic retroperitoneal fibrosis revisited », Int Urol Nephrol, (lire en ligne)
- ↑ (en) Massimo Nesti, « Malignant mesothelioma in Italy, 1997 », Am J Ind Med, (lire en ligne)
- ↑ 13,0 13,1 13,2 et 13,3 (en) Augusto Vaglio, « Idiopathic Retroperitoneal Fibrosis », Journal of the American Society of Nephrology, (ISSN 1533-3450, lire en ligne)
- ↑ 14,0 et 14,1 (en) Augusto Vaglio, « Retroperitoneal fibrosis: new insights into clinical presentation and diagnosis », Medicine (Baltimore), (lire en ligne)
- ↑ (en) H Schulte-Baukloh, « Scrotal involvement with idiopathic retroperitoneal fibrosis », Journal of Urology, (lire en ligne)
- ↑ (en) L R Baker, « Idiopathic retroperitoneal fibrosis. A retrospective analysis of 60 cases », British Journal of Urology, (lire en ligne)
- ↑ 17,0 et 17,1 (en) Kevin Day, « Retroperitoneal fibrosis », Journal of Urology, (lire en ligne)
- ↑ 18,0 18,1 18,2 18,3 18,4 18,5 et 18,6 Ferri, Fred F.,, Ferri's clinical advisor 2021 (ISBN 978-0-323-71334-4 et 0-323-71334-3, OCLC 1162353749, lire en ligne)
- ↑ 19,00 19,01 19,02 19,03 19,04 19,05 19,06 19,07 19,08 19,09 19,10 19,11 et 19,12 (en) Paul J. Scheel et Nancy Feeley, « Retroperitoneal Fibrosis », Rheumatic Disease Clinics of North America, vol. 39, no 2, , p. 365–381 (DOI 10.1016/j.rdc.2013.02.004, lire en ligne)
- ↑ (en) Carmel G Cronin, « Retroperitoneal fibrosis: a review of clinical features and imaging findings », AJR Am J Roentgenol, (lire en ligne)
- ↑ (en) L Dalla-Palma, « Computed tomography in the diagnosis of retroperitoneal fibrosis », Urology radiology, (lire en ligne)
- ↑ https://www.ncbi.nlm.nih.gov/pubmed/28070877
- ↑ (en) M.S.Hamdi, « Insuffisance rénale révélant une fibromatose rétro-péritonéale », La Revue de Médecine interne, (lire en ligne)
- ↑ (en) Emley TE, « Ureteropelvic junction obstruction due to inflammatory pseudotumor masquerading as hydronephrosis because of a neuropathic bladder in a child with myelomeningocele », Journal of Urology, (lire en ligne)
- ↑ (en) Stoeckle E, « Prognostic factors in retroperitoneal sarcoma: a multivariate analysis of a series of 165 patients of the French Cancer Center Federation Sarcoma Group », Cancer, (lire en ligne)
- ↑ (en) J. Testart, « Anévrismes inflammatoires de l'aorte abdominale », Journal des Maladies Vasculaires, (lire en ligne)
- ↑ (en) Harreby M, « Retroperitoneal fibrosis treated with methylprednisolon pulse and disease-modifying antirheumatic drugs », Scand J Urol Nephrol, (lire en ligne)
- ↑ 28,0 et 28,1 (en) Augusto Vaglio, « Prednisone versus tamoxifen in patients with idiopathic retroperitoneal fibrosis: an open-label randomised controlled trial », Lancet, (lire en ligne)
- ↑ E.F.H. van Bommel, L.G. Pelkmans, H. van Damme et T.R. Hendriksz, « Long-term safety and efficacy of a tamoxifen-based treatment strategy for idiopathic retroperitoneal fibrosis », European Journal of Internal Medicine, vol. 24, no 5, , p. 444–450 (ISSN 0953-6205, DOI 10.1016/j.ejim.2012.11.010, lire en ligne)
- ↑ (en) Renzo Marcolongo, « Immunosuppressive therapy for idiopathic retroperitoneal fibrosis: a retrospective analysis of 26 cases », American Journal of Medicine, (lire en ligne)
- ↑ (en) Paul J Scheel Jr, « Combined prednisone and mycophenolate mofetil treatment for retroperitoneal fibrosis », Journal of Urology, (lire en ligne)
- ↑ (en) D al-Musawi, « Idiopathic retroperitoneal fibrosis treated with tamoxifen only », British Journal of Urology, (lire en ligne)
- ↑ (en) O I Lindell, « Surgical treatment of ureteric obstruction in idiopathic retroperitoneal fibrosis », Scand J Urol Nephrol Suppl., (lire en ligne)
- ↑ (en) Nicholas R Styn, « University of Michigan surgical experience with ureterolysis for retroperitoneal fibrosis: a comparison of laparoscopic and open surgical approaches », Journal of Urology, (lire en ligne)
- ↑ (en) M Carini, « Surgical treatment of retroperitoneal fibrosis with omentoplasty », Journal of Surgery, (lire en ligne)
- ↑ (en) David A Duchene, « Multi-institutional survey of laparoscopic ureterolysis for retroperitoneal fibrosis », Journal of Urology, (lire en ligne)
- ↑ (en) Palmisano A, « Peri-renal collateral circles », Urology, (lire en ligne)
- ↑ (en) van Bommel EF, « Idiopathic retroperitoneal fibrosis: prospective evaluation of incidence and clinicoradiologic presentation », Medicine (Baltimore), (lire en ligne)
- ↑ (en) Faisal Aziz, « Retroperitoneal fibrosis: A rare cause of both ureteral and small bowel obstruction », World J Gastroenterol, (lire en ligne)
- ↑ (en) J G McCarthy, « Retroperitoneal fibrosis and large bowel obstruction: case report and review of the literature. », Ann Surg, (lire en ligne)
