« Cancer de la vésicule biliaire » : différence entre les versions
(→Questionnaire : ajout facteur de risque + notes) |
(→Histopathologie : ajout tableau) |
||
| Ligne 122 : | Ligne 122 : | ||
** elle peut distinguer le caractère malin ou bénin de la tumeur et identifier une maladie occulte à un stade avancé afin d'éviter une intervention chirurgicale inutile. | ** elle peut distinguer le caractère malin ou bénin de la tumeur et identifier une maladie occulte à un stade avancé afin d'éviter une intervention chirurgicale inutile. | ||
=== Histopathologie === | === Histopathologie === | ||
L'adénocarcinome consiste la grande majorité des modifications histopathologiques du cancer de la vésicule biliaire (90 %). Cette affection évolue de la dysplasie pré-néoplasique au carcinome in situ et, finalement, au cancer invasif, après environ 15 ans d'inflammation. Le carcinome épidermoïde est rare dans la vésicule biliaire. Le développement d'une masse est un autre type de lésion qui peut expliquer l'histopathologie de ce cancer, mais il n'est qu'occasionnel et peu fréquent. <ref name=":0" /><ref name=":17" /> | L'adénocarcinome consiste la grande majorité des modifications histopathologiques du cancer de la vésicule biliaire (90 %). Cette affection évolue de la dysplasie pré-néoplasique au carcinome in situ et, finalement, au cancer invasif, après environ 15 ans d'inflammation. Le carcinome épidermoïde est rare dans la vésicule biliaire. Le développement d'une masse est un autre type de lésion qui peut expliquer l'histopathologie de ce cancer, mais il n'est qu'occasionnel et peu fréquent. <ref name=":0" /><ref name=":17" /><!-- Je trouvais ça plus joli de mettre l'info en tableau qu'en liste à puces --> | ||
' | {| class="wikitable" | ||
|+Caractéristiques physiopathologiques des néoplasies de la vésicule biliaire | |||
! colspan="4" |<u>Bénins</u> | |||
|- | |||
!Épithélial | |||
!Mésenchymateux | |||
!Pseudo-tumeurs | |||
!Facteur de risque de malignité pour les polypes | |||
|- | |||
| | |||
* adénome | |||
| | |||
* hémangiomes | |||
* fibromes | |||
* lipomes | |||
| | |||
* polypes de cholestérol (+ fréquents) | |||
* polypes inflammatoires | |||
* adénomyomes (sinus Rokitansky-Aschoff) | |||
| | |||
* > 1cm | |||
* < 3polypes | |||
* sessile | |||
* envahissement muqueux | |||
|} | |||
{| class="wikitable" | |||
! colspan="4" |<u>Malins</u> | |||
|- | |||
!Localisation | |||
!Pahtologie | |||
!Types | |||
!Essaimage | |||
|- | |||
| | |||
* 60% au fundus | |||
* 30% au corps | |||
* 10% au col | |||
| | |||
* adénocarcinome (#1) | |||
* adénosquameux, à petites cellules, sarcome, mélanome, lymphome, carcinoïde (+ rares) | |||
| | |||
* infiltratif (au-delà de sous-séreux) | |||
* nodulaire (envahissement adjacent précoce, rebords définis) | |||
* papillaire (meilleur pronostic s'il est polypoïde, dans la lumière et peu envahissant) | |||
* nodulo-infiltratif ou papillo-infiltratif | |||
| | |||
* lymphatique (via le rétropéritoine) | |||
* à distance (aux poumons) | |||
|} | |||
==Diagnostic== | |||
{| class="wikitable" | {| class="wikitable" | ||
|+ | |+ | ||
| Ligne 214 : | Ligne 266 : | ||
|} | |} | ||
''Le système de stadification préféré est le TNM de l'American Joint Committee on Cancer 2010 divisé GC du stade 0 au stade IV fortement corrélé avec une survie globale à 5 ans de 81 %, 50 %, 29 %, 7-8 % et 2-3 %, respectivement.<ref name=":0" /><ref name=":8">{{Citation d'un article|prénom1=Hiromichi|nom1=Ito|prénom2=Kaori|nom2=Ito|prénom3=Michael|nom3=D'Angelica|prénom4=Mithat|nom4=Gonen|titre=Accurate staging for gallbladder cancer: implications for surgical therapy and pathological assessment|périodique=Annals of Surgery|volume=254|numéro=2|date=2011-08|issn=1528-1140|pmid=21617582|doi=10.1097/SLA.0b013e31822238d8|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/21617582/|consulté le=2023-02-09|pages=320–325}}</ref><ref name=":7">{{Citation d'un article|prénom1=B. L.|nom1=Strom|prénom2=G.|nom2=Maislin|prénom3=S. L.|nom3=West|prénom4=B.|nom4=Atkinson|titre=Serum CEA and CA 19-9: potential future diagnostic or screening tests for gallbladder cancer?|périodique=International Journal of Cancer|volume=45|numéro=5|date=1990-05-15|issn=0020-7136|pmid=2335386|doi=10.1002/ijc.2910450505|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/2335386/|consulté le=2023-02-09|pages=821–824}}</ref>'' | ''Le système de stadification préféré est le TNM de l'American Joint Committee on Cancer 2010 divisé GC du stade 0 au stade IV fortement corrélé avec une survie globale à 5 ans de 81 %, 50 %, 29 %, 7-8 % et 2-3 %, respectivement.<ref name=":0" /><ref name=":8">{{Citation d'un article|prénom1=Hiromichi|nom1=Ito|prénom2=Kaori|nom2=Ito|prénom3=Michael|nom3=D'Angelica|prénom4=Mithat|nom4=Gonen|titre=Accurate staging for gallbladder cancer: implications for surgical therapy and pathological assessment|périodique=Annals of Surgery|volume=254|numéro=2|date=2011-08|issn=1528-1140|pmid=21617582|doi=10.1097/SLA.0b013e31822238d8|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/21617582/|consulté le=2023-02-09|pages=320–325}}</ref><ref name=":7">{{Citation d'un article|prénom1=B. L.|nom1=Strom|prénom2=G.|nom2=Maislin|prénom3=S. L.|nom3=West|prénom4=B.|nom4=Atkinson|titre=Serum CEA and CA 19-9: potential future diagnostic or screening tests for gallbladder cancer?|périodique=International Journal of Cancer|volume=45|numéro=5|date=1990-05-15|issn=0020-7136|pmid=2335386|doi=10.1002/ijc.2910450505|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/2335386/|consulté le=2023-02-09|pages=821–824}}</ref>''[[Fichier:Tumeur de la vésicule biliaire.png|vignette|A) Tumeur de la vésicule biliaire B) Coupe histologique de la tumeur montrant du tissu nécrotique]] | ||
[[Fichier:Tumeur de la vésicule biliaire.png|vignette|A) Tumeur de la vésicule biliaire B) Coupe histologique de la tumeur montrant du tissu nécrotique]] | |||
==Diagnostic différentiel== | ==Diagnostic différentiel== | ||
Le différentiel diagnostic de la maladie est <ref name=":0" /><ref name=":17" /> : | Le différentiel diagnostic de la maladie est <ref name=":0" /><ref name=":17" /> : | ||
Version du 18 mars 2023 à 15:55
| Maladie | |
| Caractéristiques | |
|---|---|
| Signes | Ascite, Hépatomégalie, Masse abdominale, Obstruction de l'intestin grêle, Lymphadénopathie (approche clinique), Nodule ombilicale, Nodule de soeur-marie-joseph, Carcinomatose |
| Symptômes |
Anorexie , Nausées, Contact infectieux, Sueurs nocturnes, Fatigue , Douleur abdominale, Asymptomatique , Prurit cutané , Vomissement , Perte de poids , ... [+] |
| Diagnostic différentiel |
Colique biliaire, Hémangiome, Fibrome, Lipome, Cholécystite aiguë, Hépatome, Sténose des voies biliaires, Cholédocholithiase, Cholangite aiguë, Cholécystite alithiasique, ... [+] |
| Informations | |
| Terme anglais | Gallbladder Cancer |
| Autres noms | Cancer vésiculaire |
| Wikidata ID | Q977787 |
| Spécialités | chirurgie générale, gastro-entérologie, oncologie |
|
| |
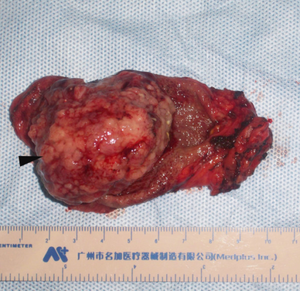
Le cancer de la vésicule biliaire est une néoplasie rare mais souvent fatale. Il s'agit d'une tumeur agressive avec une présentation souvent tardive. Le cancer de la vésicule biliaire ne représente que 3 à 4% des cancers digestifs. Il reste de mauvais pronostic et peu étudié du fait de sa rareté.
Épidémiologie
L'incidence du cancer de la vésicule biliaire dépend essentiellement de la localisation géographique. Il est plus élevé dans les populations asiatiques et d'Amérique latine (ex. le Chili, l'Inde, le Pakistan, la Corée, le Japon et Israel) en raison de la forte prévalence de calculs biliaires et d'infections chroniques de la vésicule biliaire dans ces régions. L'American Cancer Society estime 11 740 nouveaux cas de cancer de la vésicule biliaire et 3 830 décès aux États-Unis avec une prépondérance féminine en 2017. L'incidence globale du cancer de la vésicule biliaire a diminué chez les patients de plus de 50 ans mais a augmenté dans la population plus jeune. Le cancer de la vésicule biliaire est plus fréquent chez les Caucasiens, les Autochtones du Sud-Ouest et les Américains hispaniques et moins fréquent chez les Afro-Américains. L'incidence des femmes qui développent cette néoplasie est 3 à 6 fois plus grande que celle des hommes. [1][2]
Étiologies
Les étiologies de cette maladie ne sont pas bien définies encore, rares sont les articles qui proposent des causes soutenues par des preuves solides. Parmi celles proposées, certains suggèrent l'implication des facteurs menstruels et reproductifs ou des hormones féminines étant donné la forte incidence chez les femmes, mais d'autres études sont nécessaires. [2] L'adénocarcinome est le type histologique le plus fréquemment trouvé, mais il ne provient pas d'un adénome comme on le voit habituellement dans les organes creux digestifs.
Physiopathologie
Quelques hypothèses pour expliquer le cancer de la vésicule biliaire existe, mais elles ne sont pas encore bien comprises et définies.
Parmi celles-ci, une explique que des mutations seraient les responsables en s'accumulant et en conduisant à un transformation maligne. L'inflammation semble être à l'origine de ces mutations. L'inflammation peut être causée par la présence de cholélithiase(s) et/ou d'agents pathogènes infectieux. La carcinogenèse des lithiases vésiculaires pourrait résulter de traumatismes itératifs et de l'irritation chronique. Cependant, des dérivés carcinogènes des acides biliaires peuvent également jouer un rôle. Les mutations les plus fréquemment décrites sont les oncogènes K-ras et les suppresseurs de tumeurs bêta-caténine (CTNNB1). La recherche n'a révélé aucun risque familial héréditaire. [3]
D'autres recherches pointent du doigts le phénomène de reflux pancréatico-biliaire. Effectivement, celui-ci survient lorsqu'une anomalie est présente au niveau de la jonction des voies biliaires et pancréatique. Le conduit commun qui relie le cholédoque et le cancal de Wirsung serait particulièrement long, menant à une jonction hors de la paroi duodénal. Cela augmenterait la résistances dans les canaux pancréatiques et biliaires, réduirait ainsi le débit des sécrétions, mènerait à un reflux des sucs pancréatiques vers les voies biliaires et annulerait l'effet régulateur du sphincter d'Oddi. Il en résulterait une inflammation chronique de l'endothélium biliaire menant à une érosion et une régénération de la membrane endothéliale. Ce renouvellement cellulaire favoriserait une dysplasie et une transformation maligne. Finalement, la stagnation et la concentration de la bile dans la vésicule biliaire exacerberaient les effets cancérigènes, donc le cancer de la vésicule biliaire serait le site le plus fréquent de survenue de cancer par ce mécanisme.[4][5][6]
Présentation clinique
Facteurs de risque
Les facteurs de risque de cette maladie sont [1][2][7][8] :
- le facteur de risque 1 - Ceci est une balise sémantique de type facteur de risque que vous devez modifier.
- le facteur de risque 2 - Ceci est une balise sémantique de type facteur de risque que vous devez aussi modifier.
- le facteur de risque 3 - Copiez ce modèle pour définir d'autres facteurs de risques.
- les facteurs non-modifiables :
- l'âge
- le sexe féminin
- les mutations génétiques (ex. K-ras, CTNNB1)
- l'ethnicité.
- une maladie auto-immune :
- la maladie de Crohn (OR: 1.83, 95%CI: 1.23–2.71)
- l'anémie pernicieuse (OR: 1.28, 95% CI: 1.09–1.52)
- la cholangite sclérosante primitive chronique (OR: 2.06, 95% CI: 1.27–3.33).
- les habitudes de vie :
- le tabagisme
- l'apport élevé en glucides
- l'obésité.
- l'inflammation chronique est le facteur de risque le plus critique causé par :
- les cholélithiases (80-100% des patients porteurs d'une néoplasie en ont)
- les polypes de la vésicule biliaire
- les kystes biliaires congénitaux
- les malformations congénitales du canal pancréaticobiliaire
- la cholangite bactérienne chronique souvent causée par Salmonella (ex. typhi et parathyphi) et Helicobacter bilis.
- les cancérogènes (ex. la méthyldopa, l'isoniazide)
- l'exposition au travail (ex. la méthylcellulose, le radon, les métaux lourds)
- le diabète mellitus
- la vésicule biliaire en porcelaine (entre 0% et 6% d'association selon les plus récentes études). [9][10][11][note 1]
Questionnaire
Les patients atteints d'un cancer de la vésicule biliaire sont souvent asymptomatiques ou décrivent des symptômes vagues. Les symptômes de cette maladie sont [1][12]:
- le symptôme 1 - Ceci est une balise sémantique de ty pe symptôme que vous devez modifier.[Se: 15 %[13]][Sp: 100 %[14]][VPP: 100 %[15]][VPN: 88 %[16]]
- le symptôme 2 - Ceci est une balise sémantique de type symptôme que vous devez aussi modifier.
- le symptôme 3 - Copiez ce modèle pour définir d'autres symptômes.[Se: 25 %[17]][Sp: 40 %[18]][VPP: 70 %[19]][VPN: 88 %[20]]
- l 'élément d'histoire 1 zones endémique ou contact infectieux avec Salmonella (ex. typhi et parathyphi) ou Helicobacter bilis
- des douleurs abdominales (souvent au quadrant supérieur droit)
- des nausées ou vomissements
- une indigestion
- de la faiblesse
- de l'anorexie
- une perte d'appétit
- s'il y a obstruction secondaire des voies biliaires :
- des selles de couleur argileuse
- une urine de couleur cola
- un prurit cutané
- un malaise général
- des symptômes B (ex. perte de poids).
Examen clinique
L'examen clinique permet d'objectiver les signes suivants [21] :
- à l'examen clinique 1 examen physique abdominal :
- le signe clinique 1[Se: 15 %[22]][Sp: 100 %[23]][VPP: 100 %[24]][VPN: 88 %[25]]
- le signe clinique 2
- l'hépatomégalie
- la masse abdominale palpable
- l'ascite
- l'occlusion intestinale (indique un stade métastatique avancé)
- un nodule ombilicale (ex. nodule de soeur-marie-joseph, carcinomatose).
- l'examen clinique 2 la palpation des ganglions:
- le signe clinique 3
- des adénopathies sus-claviculaires gauches.
Examens paracliniques
Laboratoires
Les analyses sanguines suivantes sont utiles pour le diagnostic de cette maladie [8][26][27] :
- marqueurs tumoraux CEA et CA 19-9 :
- Les marqueurs tumoraux, tels que l'antigène carcinoembryonnaire et l'antigène glucidique19-9, sont fréquemment élevés mais considérés comme non diagnostiques en raison du manque de spécificité (CA 19-9 92,7 % contre 79,2 % CEA) et de sensibilité (CA 19-9 50 % contre 79,4 % ACE). Les tests de référence CEA et CA 19-9 sont utiles pour surveiller la réponse au traitement.
- une FSC
- un bilan chimique de base
- un bilan hépatique :
- un test de la fonction hépatique
- une évaluation d'inflammation hépatobiliaire ou d'une lésion sous-jacente (ex. virus de l'hépatite B ou C, maladies auto-immunes, etc.)
- l'examen paraclinique 1[Se: 15 %[28]][Sp: 100 %[29]][VPP: 100 %[30]][VPN: 88 %[31]] :
- le signe paraclinique 1
- le signe paraclinique 2
- Exemple de recommandation. [A, 2]
- l'examen paraclinique 2 :

Imagerie
Les imageries suivantes peuvent être demandées lorsqu'on suspecte un cancer de la vésicule biliaire [1][8][26][27] :
- l'échographie endoscopique transabdominale
- elle permet une description précise du stade du cancer, de la profondeur de l'invasion et de la lymphadénopathie locale
- permet de voir s'il y a de l'ascite
- la tomodensitométrie thoraco-abdomino-pelvienne
- elle est utile pour détecter les extensions de la pathologie au foie, aux ganglions lymphatiques ou la présence de métastases. Avec une précision jusqu'à 93%, on peut déterminer si la vésicule biliaire est résécable avant toute opération
- la résonance magnétique dynamique et la cholangiopancréatographie par RM (MRCP)
- elles permettent d'évaluer l'étendue de la maladie et d'identifier les candidats non résécables présentant une invasion du ligament hépatoduodénal, un enrobage vasculaire et/ou une atteinte des ganglions lymphatiques (sensibilité et spécificité proche de 100%)
- tomographie par émission de positons/tomodensitométrie (PET/CT)
- elle peut distinguer le caractère malin ou bénin de la tumeur et identifier une maladie occulte à un stade avancé afin d'éviter une intervention chirurgicale inutile.
Histopathologie
L'adénocarcinome consiste la grande majorité des modifications histopathologiques du cancer de la vésicule biliaire (90 %). Cette affection évolue de la dysplasie pré-néoplasique au carcinome in situ et, finalement, au cancer invasif, après environ 15 ans d'inflammation. Le carcinome épidermoïde est rare dans la vésicule biliaire. Le développement d'une masse est un autre type de lésion qui peut expliquer l'histopathologie de ce cancer, mais il n'est qu'occasionnel et peu fréquent. [1][21]
| Bénins | |||
|---|---|---|---|
| Épithélial | Mésenchymateux | Pseudo-tumeurs | Facteur de risque de malignité pour les polypes |
|
|
|
|
| Malins | |||
|---|---|---|---|
| Localisation | Pahtologie | Types | Essaimage |
|
|
|
|
Diagnostic
| Tumeur primaire (T) | ||
|---|---|---|
| TX | Impossible d'évaluer la tumeur | |
| T0 | Aucune évidence de tumeur primaire | |
| Tis | Carcinome in situ | |
| T1 | T1a | Envahissement de la lamina propria |
| T1b | Envahissement de la couche musculaire | |
| T2 | T2a | Envahissement du tissu conjonctif périmusculaire du côté péritonéal sans extension à la séreuse |
| T2b | Envahissement du tissu conjonctif périmusculaire du côté hépatique sans extension au foie | |
| T3 | Perforation de la séreuse (péritoine viscéral) et/ou envahissement direct du foie et/ou d'un autre organe ou d'une structure adjacent (ex. l'estomac, le duodénum, le côlon, le pancréas, l'épiploon, les voies biliaires extrahépatiques) | |
| T4 | Envahissement de la veine porte principale, ou de l'artère hépatique, ou de deux organes, ou ≥ 2 structures extrahépatiques | |
| Ganglions régionaux | ||
| NX | Impossible d'évaluer les ganglions | |
| N0 | Aucune métastase lymphatique | |
| N1 | 1-3 ganglions atteints par métastases | |
| N2 | ≥ 4 ganglions atteints par métastases | |
| Métastases à distance | ||
| M0 | Aucune métastase à distance | |
| M1 | Présence de métastases à distance | |
| Stades | ||
| Stade 0 | Tis + N0 + M0 | |
| Stade IA | T1a + N0 + M0 | |
| Stade IB | T1b + N0 + M0 | |
| Stade IIA | T2a + N0 + M0 | |
| Stade IIB | T2b + N0 + M0 | |
| Stade IIIA | T3 + N0 + M0 | |
| Stade IIIB | T1/T2/T3 + N1 + M0 | |
| Stade IVA | T4 + N0/N1 + M0 | |
| Stade IVB | N'importe quel T + N2 + M0 | |
| N'importe quel T + N'importe quel N + M1 | ||
Le système de stadification préféré est le TNM de l'American Joint Committee on Cancer 2010 divisé GC du stade 0 au stade IV fortement corrélé avec une survie globale à 5 ans de 81 %, 50 %, 29 %, 7-8 % et 2-3 %, respectivement.[1][40][41]

Diagnostic différentiel
Le différentiel diagnostic de la maladie est [1][21] :
- le diagnostic différentiel 1
- le diagnostic différentiel 2
- le diagnostic différentiel 3
- une cholécystite alithiasique
- un carcinome de l'ampoule de Vater
- une sténoses des voies biliaires
- une tumeur des voies biliaires
- une colique biliaire
- une obstruction des voies biliaires
- une cholangite
- une cholécystite
- des polypes de cholestérol
- adénomyomatose de la vésicule
- vésicule de Courvoisier
- vésicule porcelaine
- hépatome
Traitement
| Types de cancer | Types de traitement | Recommandations |
|---|---|---|
| Tumeur locale et/ou locorégionale | Chirurgie | Les modalités chirurgicales doivent être déterminées au préalable par une équipe de spécialiste, mais la chirurgie radicale avec lymphadénectomie représente la seule option curative. Pour un patient en bonne condition, chez qui l'on découvre un cancer ≥ T1b sans métastase lors d'une cholécystectomie, il est indiqué de réopérer en réséquant radicalement. De plus, (à vérifier) = resection of some or all of segment IVb/V of the liver is carried out together with a lymphadenectomy of the hepatoduode- nal ligament [II, A]. |
| Traitements adjuvants | Il consiste en :
| |
| Tumeur avancée et métastasique | Traitements de première intention |
|
| Traitements de deuxième intention |
|
Le traitement de la maladie localement avancée et métastatique repose sur la chimiothérapie palliative. À l'inverse, le stade précoce est potentiellement curatif avec une résection chirurgicale suivie d'un traitement adjuvant.[1]
Les traitements proposés sont les suivants :
- le programme d'exercice 1
- Exemple de recommandation. [B, 2]
- le traitement non-pharmacologique 2
- Médicament 80 mg PO TID x 7j
Le traitement néoadjuvant n'est souvent pas une option en raison du stade avancé de la maladie au moment du diagnostic et n'est pas considéré comme une norme de soins dans les cas résécables. L'orientation vers des essais cliniques précoces mérite d'être envisagée.[42][1]
La chirurgie est le seul traitement curatif pour les patients de stade II ou moins et sans contre-indications (voir évaluation). La résection chirurgicale du cancer de la vésicule biliaire comprendra une cholécystectomie avec une hépatectomie marginale avec une lymphadénectomie régionale ou une résection du canal cholédoque (les organes étendus peuvent nécessiter une ablation). Pour le cancer de la vésicule biliaire découvert accidentellement sur un échantillon pathologique de cholécystectomie de stade T2 ou supérieur, il est recommandé de revenir pour une exploration plus approfondie et une nouvelle résection.[43]
Un chimiothérapie post-opératoire devrait être offerte dans les 8 à 12 semaines e il faudra des laboratoires et une imagerie de re-staging avec le début du traitement. Un traitement adjuvant doit être proposé aux patients présentant un rapport d'échantillon pathologique réséqué de T2 ou supérieur, avec atteinte ganglionnaire et marge positive, de préférence pendant six mois de chimiothérapie adjuvante (ACT) ou alternative de quatre mois avec chimioradiothérapie adjuvante concomitante (ACRT ).[44][1]
Les directives consensuelles du National Comprehensive Cancer Network (NCCN) suggèrent les recommandations suivantes[45] :[1]
- Chemotherapy alone for six months with gemcitabine [1000 mg/weekly for three of every four weeks] or 5-FU (fluoropyrimidine) [leucovorin 20 mg/m suivi de FU 425 mg/m en bolus intraveineux [IV] jours 1 à 5 tous les 28 jours] publié dans l'essai ESPAC-3 avec une survie globale médiane pour CT de 43,1 mois contre 35,2 mois dans le groupe d'observation sans signification statistique (données extrapolées à partir des tumeurs malignes pancréaticobiliaires).[46]
- En plus à ce qui précède, un autre régime comprend quatre cycles de capécitabine (Cap) [1 500 mg/m² par jour les jours 1 à 14] plus la gemcitabine (Gem) [1 000 mg/intraveineuse les jours 1 et 8] tous les 21 jours, suivis d'un CRT [Cap 1330 mg/jour répartis en deux prises quotidiennes et RT 45 Gy aux lymphatiques régionaux ; 54 à 59,4 Gy au lit tumoral] publié dans un essai SWOG-S0809 à un seul bras avec des résultats médicaux attendus (mOS) de 35 mois sans groupe de comparaison.[44]
- Lastly, 5-FU [225 mg/m daily]-based ACRT from other gastrointestinal malignancy extrapolation data. Lors de l'ASCO 2017, l'étude BILCAP a été présentée comme le premier traitement adjuvant randomisé de phase 3 pour les patients sans complications post-chirurgicales et le groupe oncologique coopératif oriental de deux ou moins (ECOG < 2), 447 patients ont été randomisés 1:1 Cap N 223[ 1250mg/m D1-14 tous les 21 jours, pendant huit cycles] ou observation (Obs) N224 de 44 sites britanniques entre 2006 et 2014, il comprenait 18 % de GC, et les résultats ont montré une mOS pour Cap 53mo par rapport à l'observation pendant 36 mois (HR 0,75 p0,028). Par conséquent, Cap sera bientôt adopté comme nouvelle norme de soins.[47][1]
Les cancers de la vésicule biliaire localement avancés et métastatiques non résécables sont candidats à des fins palliatives/chimiothérapie. Un stade localement avancé peut être géré par radiothérapie externe et implique généralement un radiosensibilisateur, tel que le 5-FU, mais cette modalité permet rarement de contrôler la tumeur. Les patients aptes (ECOG 0-1) à la chimiothérapie pourraient envisager l'option de première ligne de Gem [1 000 mg/m] plus cisplatine (cis) [25 mg/m] les jours 1 et 8 toutes les trois semaines avec une toxicité acceptable comme publié dans l'essai randomisé ABC-02 qui comprenait 148 patients atteints d'un cancer de la vésicule biliaire et avait une MOS de 11,7 mois dans le bras combiné par rapport à 8,3 mois de Gem seul (HR, 0,70 ; p0,002).[48] Autre gem- les combinaisons basées sur le 5-FU ne sont pas une comparaison randomisée, et les études à un seul bras ont rapporté une MOS pour GemCap 12,7 mois, Gem avec Oxaliplatine 14,3 mois à la fois sur une population sélectionnée ou une combinaison alternative à base de 5-FU plus Cis 11,5 mois ou Cap 11,3 mois.[49] Médiocre les patients performants peuvent recevoir un agent oral unique Cap plus tolérable et moins toxique avec une MOS rapportée de 9,9 mois, par rapport aux meilleurs soins de soutien de 4,5 mois. Tous les patients atteints d'une maladie avancée non résécable devraient recevoir des offres de participation à des essais cliniques.[1]
Suivi
Suite aux traitements, le suivi comprend un questionnaire, un examen physique assidu, des examens de laboratoire, la mesure de marqueurs tumoraux et une TDM thoraco-abdomino-pelvienne à chaque 3-6 mois pour une période de 2 ans. Les visites régulières peuvent être continuées pendant 3 années supplémentaires, et être changées pour des visites annuelles après 5 ans de suivi.[27] Les oncologues peuvent surveiller étroitement les patients avec des tests de la fonction hépatique et des marqueurs tumoraux (CEA et CA19-9) tous les trois à quatre mois pendant deux ans, puis tous les six mois jusqu'à cinq ans. Toutes les autres investigations peuvent avoir lieu lorsqu'elles sont cliniquement indiquées. [1]
Complications
La principale complication de cette maladie est la récidive tumorale. Si le patient présente des douleurs abdominales, un ictère obstructif et une perte de poids significative, une récidive régionale avec atteinte intra-abdominale doit être suspectée .[1]
Évolution
La survie globale pour le cancer de la vésicule biliaire est généralement faible à cause du caractère agressif des tumeurs, de la présentation tardive, de la complexité de la position anatomique et du stade avancé au moment du diagnostic. Les taux de survie à 1 an et 5 ans ne dépassent pas les 20% en général.[50] La survie à 5 ans par stade est [8][51] :
- au stade 0 : 80%
- au stade I : 50%
- au stade II : 28%
- au stade IIIa : 8%
- au stade IIIb : 7%
- au stade IVa : 4%
- au stade IVb : 2%
Les facteurs pronostiques pour cette maladie sont [1][8] :
- le stade TNM à l'investigation de départ
- la localisation spécifique de la tumeur
- l'opérabilité de la tumeur
- la réponse à la chimiothérapie
- la présence de jaunisse
- la propagation néoplasique.
De plus, le syndrome de Mirizzi (obstruction du canal hépatique commun par une pierre impactée dans le col de la vésicule biliaire due à une compression extrinsèque) a montré une association avec le cancer de la vésicule biliaire. Elle est de mauvais pronostic car non résécable à la présentation. [12]
Notes
- ↑ La vésicule en porcelaine est une trouvaille occasionnelle à l'imagerie et elle était anciennement associée à un facteur de risque important du cancer de la vésicule biliaire. Cependant, plusieurs articles récents démontrent qu'elle représente un facteur de risque plutôt faible pour cette pathologie.
Références
- Cette page a été modifiée ou créée le 2023/01/26 à partir de Gallbladder Cancer (StatPearls / Gallbladder Cancer (2022/07/10)), écrite par les contributeurs de StatPearls et partagée sous la licence CC-BY 4.0 international (jusqu'au 2022-12-08). Le contenu original est disponible à https://www.ncbi.nlm.nih.gov/pubmed/28723031 (livre).
- Cet article a été créé en partie ou en totalité le 2023-02-12 à partir de Chirurgie (application), créée par Dre Hélène Milot, Dr Olivier Mailloux et collaborateurs et partagé sous la licence CC-BY-SA 4.0 international
- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 1,11 1,12 1,13 1,14 et 1,15 Shiva Kumar R. Mukkamalla, Sarang Kashyap, Alejandro Recio-Boiles et Hani M. Babiker, StatPearls, StatPearls Publishing, (PMID 28723031, lire en ligne)
- ↑ 2,0 2,1 et 2,2 (en) Mikayla A. Schmidt, Lorena Marcano-Bonilla et Lewis R. Roberts, « Gallbladder cancer: epidemiology and genetic risk associations », Chinese Clinical Oncology, vol. 8, no 4, , p. 31–31 (ISSN 2304-3873 et 2304-3865, DOI 10.21037/cco.2019.08.13, lire en ligne)
- ↑ Amir A. Rahnemai-Azar, Allison Weisbrod, Mary Dillhoff et Carl Schmidt, « Intrahepatic cholangiocarcinoma: Molecular markers for diagnosis and prognosis », Surgical Oncology, vol. 26, no 2, , p. 125–137 (ISSN 1879-3320, PMID 28577718, DOI 10.1016/j.suronc.2016.12.009, lire en ligne)
- ↑ (en) Bertrand Le Roy, Johan Gagnière, Laura Filaire et Mikael Fontarensky, « Pancreaticobiliary maljunction and choledochal cysts: from embryogenesis to therapeutics aspects », Surgical and Radiologic Anatomy, vol. 38, no 9, , p. 1053–1060 (ISSN 0930-1038 et 1279-8517, DOI 10.1007/s00276-016-1669-y, lire en ligne)
- ↑ (en) Terumi Kamisawa, Hajime Anjiki, Naoto Egawa et Masanao Kurata, « Diagnosis and clinical implications of pancreatobiliary reflux », World Journal of Gastroenterology, vol. 14, no 43, , p. 6622 (ISSN 1007-9327, PMID 19034962, Central PMCID PMC2773301, DOI 10.3748/wjg.14.6622, lire en ligne)
- ↑ (en) Terumi Kamisawa, Masanao Kurata, Goro Honda et Kouji Tsuruta, « Biliopancreatic reflux—pathophysiology and clinical implications », Journal of Hepato-Biliary-Pancreatic Surgery, vol. 16, no 1, , p. 19–24 (ISSN 0944-1166 et 1436-0691, DOI 10.1007/s00534-008-0010-5, lire en ligne)
- ↑ I. Roa, J. C. Araya, M. Villaseca et X. De Aretxabala, « Preneoplastic lesions and gallbladder cancer: an estimate of the period required for progression », Gastroenterology, vol. 111, no 1, , p. 232–236 (ISSN 0016-5085, PMID 8698204, DOI 10.1053/gast.1996.v111.pm8698204, lire en ligne)
- ↑ 8,0 8,1 8,2 8,3 et 8,4 (en) Mislav Rakic, Leonardo Patrlj, Mario Kopljar et Robert Klicek, « Gallbladder cancer », Hepatobiliary Surgery and Nutrition, vol. 3, no 5, , p. 22126–22226 (ISSN 2304-389X et 2304-3881, PMID 25392833, Central PMCID PMC4207839, DOI 10.3978/j.issn.2304-3881.2014.09.03, lire en ligne)
- ↑ Kimberly M. Brown, « Porcelain Gallbladder and Risk of Gallbladder Cancer », Archives of Surgery, vol. 146, no 10, , p. 1148 (ISSN 0004-0010, DOI 10.1001/archsurg.2011.258, lire en ligne)
- ↑ (en) Thomas Schnelldorfer, « Porcelain Gallbladder: A Benign Process or Concern for Malignancy? », Journal of Gastrointestinal Surgery, vol. 17, no 6, , p. 1161–1168 (ISSN 1091-255X et 1873-4626, DOI 10.1007/s11605-013-2170-0, lire en ligne)
- ↑ (en) Zarrish S. Khan, « Reassessing the Need for Prophylactic Surgery in Patients With Porcelain Gallbladder: Case Series and Systematic Review of the Literature », Archives of Surgery, vol. 146, no 10, , p. 1143 (ISSN 0004-0010, DOI 10.1001/archsurg.2011.257, lire en ligne)
- ↑ 12,0 et 12,1 Theegala L. V. D. Prasad, Ashok Kumar, Sadiq S. Sikora et Rajan Saxena, « Mirizzi syndrome and gallbladder cancer », Journal of Hepato-Biliary-Pancreatic Surgery, vol. 13, no 4, , p. 323–326 (ISSN 0944-1166, PMID 16858544, DOI 10.1007/s00534-005-1072-2, lire en ligne)
- ↑ url
- ↑ url
- ↑ url
- ↑ url
- ↑ url
- ↑ url
- ↑ url
- ↑ url
- ↑ 21,0 21,1 et 21,2 (en) Biliary Tract and Gallbladder Cancer: A Multidisciplinary Approach, Springer Berlin Heidelberg, coll. « Medical Radiology », (ISBN 978-3-642-40557-0 et 978-3-642-40558-7, DOI 10.1007/978-3-642-40558-7, lire en ligne)
- ↑ url
- ↑ url
- ↑ url
- ↑ url
- ↑ 26,0 et 26,1 Alessandro Furlan, James V. Ferris, Keyanoosh Hosseinzadeh et Amir A. Borhani, « Gallbladder carcinoma update: multimodality imaging evaluation, staging, and treatment options », AJR. American journal of roentgenology, vol. 191, no 5, , p. 1440–1447 (ISSN 1546-3141, PMID 18941083, DOI 10.2214/AJR.07.3599, lire en ligne)
- ↑ 27,0 27,1 27,2 27,3 et 27,4 (en) A. Vogel, J. Bridgewater, J. Edeline et R. K. Kelley, « Biliary tract cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up☆ », Annals of Oncology, vol. 34, no 2, , p. 127–140 (ISSN 0923-7534 et 1569-8041, PMID 36372281, DOI 10.1016/j.annonc.2022.10.506, lire en ligne)
- ↑ url
- ↑ url
- ↑ url
- ↑ url
- ↑ url
- ↑ url
- ↑ url
- ↑ url
- ↑ url
- ↑ url
- ↑ url
- ↑ url
- ↑ Hiromichi Ito, Kaori Ito, Michael D'Angelica et Mithat Gonen, « Accurate staging for gallbladder cancer: implications for surgical therapy and pathological assessment », Annals of Surgery, vol. 254, no 2, , p. 320–325 (ISSN 1528-1140, PMID 21617582, DOI 10.1097/SLA.0b013e31822238d8, lire en ligne)
- ↑ B. L. Strom, G. Maislin, S. L. West et B. Atkinson, « Serum CEA and CA 19-9: potential future diagnostic or screening tests for gallbladder cancer? », International Journal of Cancer, vol. 45, no 5, , p. 821–824 (ISSN 0020-7136, PMID 2335386, DOI 10.1002/ijc.2910450505, lire en ligne)
- ↑ Shiva Jayaraman et William R. Jarnagin, « Management of gallbladder cancer », Gastroenterology Clinics of North America, vol. 39, no 2, , p. 331–342, x (ISSN 1558-1942, PMID 20478489, DOI 10.1016/j.gtc.2010.02.006, lire en ligne)
- ↑ https://www.ncbi.nlm.nih.gov/pubmed/28480069
- ↑ 44,0 et 44,1 Edgar Ben-Josef, Katherine A. Guthrie, Anthony B. El-Khoueiry et Christopher L. Corless, « SWOG S0809: A Phase II Intergroup Trial of Adjuvant Capecitabine and Gemcitabine Followed by Radiotherapy and Concurrent Capecitabine in Extrahepatic Cholangiocarcinoma and Gallbladder Carcinoma », Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology, vol. 33, no 24, , p. 2617–2622 (ISSN 1527-7755, PMID 25964250, Central PMCID 4534524, DOI 10.1200/JCO.2014.60.2219, lire en ligne)
- ↑ Al B. Benson, Michael I. D'Angelica, Daniel E. Abbott et Thomas A. Abrams, « NCCN Guidelines Insights: Hepatobiliary Cancers, Version 1.2017 », Journal of the National Comprehensive Cancer Network: JNCCN, vol. 15, no 5, , p. 563–573 (ISSN 1540-1413, PMID 28476736, Central PMCID 5557008, DOI 10.6004/jnccn.2017.0059, lire en ligne)
- ↑ https://www.ncbi.nlm.nih.gov/pubmed/22782416
- ↑ « Capecitabine Extends Survival for Biliary Tract Cancer », Cancer Discovery, vol. 7, no 7, , OF1 (ISSN 2159-8290, PMID 28572460, DOI 10.1158/2159-8290.CD-NB2017-079, lire en ligne)
- ↑ Juan Valle, Harpreet Wasan, Daniel H. Palmer et David Cunningham, « Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer », The New England Journal of Medicine, vol. 362, no 14, , p. 1273–1281 (ISSN 1533-4406, PMID 20375404, DOI 10.1056/NEJMoa0908721, lire en ligne)
- ↑ Hanisah Guro, Jin Won Kim, YoungRok Choi et Jai Young Cho, « Multidisciplinary management of intrahepatic cholangiocarcinoma: Current approaches », Surgical Oncology, vol. 26, no 2, , p. 146–152 (ISSN 1879-3320, PMID 28577720, DOI 10.1016/j.suronc.2017.03.001, lire en ligne)
- ↑ R. P. Kiran, N. Pokala et S. J. Dudrick, « Incidence pattern and survival for gallbladder cancer over three decades--an analysis of 10301 patients », Annals of Surgical Oncology, vol. 14, no 2, , p. 827–832 (ISSN 1068-9265, PMID 17109082, DOI 10.1245/s10434-006-9224-4, lire en ligne)
- ↑ « Survival statistics for gallbladder cancer » (consulté le 10 février 2023)
