Condylome acuminé
| Maladie | |||
 Condylomes acuminés anaux à l'anuscopie haute résolution | |||
| Caractéristiques | |||
|---|---|---|---|
| Signes | Condylome acuminé, Papules | ||
| Symptômes |
Saignements, Douleur anale, Asymptomatique , Prurit cutané , Fomites, Détresse psychosexuelle, Douleur génitale | ||
| Diagnostic différentiel |
Molluscum contagiosum, Acrochordon, Lichen plan cutané, Psoriasis, Carcinome spinocellulaire, Condylome lata, Papules péniennes nacrées, Tumeur de Buschke-Lowenstein, Néoplasie intra-épithéliale anale, Papulose bowénoïde | ||
| Informations | |||
| Terme anglais | Condylome acuminé | ||
| Autres noms | Condylomes anogénitaux | ||
| Wikidata ID | Q208726 | ||
| Spécialités | Dermatologie, Médecine familiale, Chirurgie générale, Gynécologie, Urologie | ||
| |||

Le condylome acuminé, ou verrue anogénitale est une infection fréquente, transmise sexuellement, causée par certaines souches du virus du papillome humain (VPH).[1]
Épidémiologie
Le condylome acuminé affecte le plus souvent les personnes âgées de 20 à 39 ans, avec une forte présence chez les 20-24 ans. Aux États-Unis, l'incidence estimée par les études est de 1,1 à 1,2 cas de verrues anogénitales pour 1000 personnes-années. Au Canada, le dernier taux d'incidence homme:femme était de 1,25 et la prévalence était de 165,2/100 000 et 128,4/100 000 chez les hommes et femmes respectivement en 2004. [1][2][3][4][5]
Étiologies
L'infection par le VPH est la principale cause pour développer des condylomes acuminés. La région anogénitale peut être atteinte par 40 souches de ce virus. Parmi celles-ci, les types 6 et 11 dominent largement en étant responsable du développement de 90% des condylomes. Bien qu'ils soient considérés comme sexuellement transmissibles, il existe d'autres formes de transmission.[1][6][3]
À l'occasion, les condylomes peuvent être d'origine iatrogénique.
Physiopathologie
Le VPH est un virus à ADN double brin qui infecte le noyau des cellules épithéliales squameuses différenciées. Sa période d'incubation peut varier d'un mois à deux ans, car sa phase latente peut être de plusieurs mois. Le génome du VPH contient un oncogène qui code pour des protéines stimulant la prolifération cellulaire. Ces protéines permettent au virus de se répliquer via l'ADN polymérase de la cellule hôte pendant que les cellules hôtes subissent une division cellulaire. Au fur et à mesure que le nombre de cellules hôtes infectées par le virus augmente, les couches de l'épiderme s'épaississent, entraînant une acanthose et l'apparition macroscopique de verrues. Il faut environ trois à quatre mois pour que le condylome acuminé se forme. Chez des individus par ailleurs en bonne santé, une réponse immunitaire adéquate peut arrêter la réplication virale et résoudre l'infection au fil du temps. Néanmoins, une infection prolongée au VPH augmente le risque de transformation maligne.[3][7][8]
Présentation clinique
Facteurs de risque
Les facteurs de risque de cette maladie sont [2][3][5][9] :
- la tranche d'âge (20 à 24 ans)
- le mode de vie (ex. travailleur du sexe)
- les relations sexuelles non protégées
- les relations sexuelles anales
- un nombre plus élevé de partenaires sexuels au cours de la vie
- des antécédents d'infections à chlamydia et de gonorrhée
- le tabagisme (cessé ou actif)
- l'immunosuppression
- l'infection par le virus de l'immunodéficience humaine (VIH).
Questionnaire
Les condylomes acuminés sont généralement asymptomatiques, bien qu'ils puissent occasionnellement provoquer [8] :
- des saignements
- de la douleur anale ou génitale
- une détresse psychosexuelle causée par l'apparence des lésions
- du prurit.
Les fomites peuvent également être à l'origine de condylomes acuminés (ex. gants chirurgicaux, instruments pour une biopsie).

Examen clinique
L'examen clinique permet d'objectiver les signes suivants [3][8][10][11][12] :
- à l'examen des organes génitaux :
- des papules charnues de 1 à 5 mm de diamètre
- elles peuvent être larges et plates, pédiculées ou avoir l'apparence d'un chou-fleur
- elles se retrouvent sur le pénis, la vulve, le vagin, le col de l'utérus, le périnée et/ou la région anale
- l'apparence de la lésion dépend du type de VPH et du site d'infection
- les condylomes sont généralement multiples et peuvent fusionner en une lésion plus grande
- la présence de lésions suggère généralement une transmission sexuelle du VPH
- à l'examen buccal :
- présence d'un condylome acuminé sur la langue et/ou les lèvres.
Examens paracliniques
Les examens paracliniques pertinents sont les suivants. [3]
- Chez la femme, une colposcopie permet d'agrandir la lésion pour une meilleure visualisation au niveau du col de l'utérus ou du vagin.
- Le test de détection par PCR de la lésion permet la confirmation du diagnostic et le typage génétique du condylome.
- Le test à l'acide acétique permet d'évaluer la lésion en appliquant 5% d'acide acétique sur la lésion. L'apparition de zones blanches font craindre une dysplasie : une biopsie de la lésion est alors indiquée. Ce test n'est pas valable pour le dépistage, car il a un taux élevé de faux positifs.
- Une biopsie cutanée du tissu démontre une acanthose avec une hyperkératose sus-jacente. Des cellules distinctes appelées koïlocytes sont également identifiables. Ces cellules caractéristiques sont souvent présentes dans les couches supérieures de l'épiderme. De plus, le condylome acuminé peut être différencié de la verrue vulgaire par le type d'hyperplasie. Une hyperplasie verruqueuse pointue est observée dans la verrue vulgaire, tandis que la papillomatose apparaît dans le condylome acuminé.
Diagnostic différentiel

Le diagnostic différentiel de la maladie est [3][13][14]:
- le condylome lata
- le molluscum contagiosum
- le lichen plan cutané
- le psoriasis
- une tumeur maligne
- des papules péniennes nacrées
- un acrochordon
- des kystes sébacés
- une néoplasie intra-épithéliale anale
- une tumeur de Buschke-Lowenstein.[note 1]
Traitement
Le traitement peut être retardé chez les enfants, les adolescents et les jeunes adultes en bonne santé. En effet, environ 30% des lésions disparaissent souvent spontanément dans les quatre premiers mois, voire des années.[15] En cas de lésions symptomatiques qui persistent pendant plus de deux ans ou à des fins esthétiques, les traitements sont indiqués. [8] Le traitement dépend de la morphologie de la lésion, de la localisation et des préférences du patient. Il n'existe pas d'algorithme de traitement formel. Dans tous les cas, les patients doivent recevoir des conseils sur les options de traitement, l'importance des rendez-vous de suivi et les pratiques sexuelles sans risque.[3]
Médical
Les traitements pharmacologiques proposés pour cette maladie sont les suivants [3][16] :
- pour les papules charnues, la podophyllotoxine solution (0,5 %) BID x 3 jours ou podophyllotoxine crème (0,15 %) BID x 3 jours, suivie d'une pause de quatre jours (disparition après quatre semaines)
- imiquimod crème (5 %) 3X/semaine HS x jusqu'à 16 semaines
- sinecatéchines pommade (15 %) TID x jusqu'à 16 semaines
- cryothérapie 3 à 5 cycles de 20 secondes q 1 semaine x 6 à 10 semaines appliquée sur le bord de la lésion
- acide trichloracétique 80 à 90 % 1 fois par semaine x 8 à 10 semaines est utilisée pour les petites lésions, créant un petit ulcère qui guérit sans laisser de cicatrices
- acide 5-aminolévulinique avec la thérapie photodynamique est un traitement émergent pour le condylome acuminé[note 2].
Chaque option possède leurs avantages et inconvénients [17][18].
- L'imiquimod possède des taux de récidive plus faibles qu'avec la podophyllotoxine.
- Le traitement à base de podophyllotoxine est efficace rapidement, mais il comporte plus d'effets secondaires.
- L'imiquimod et la pommade de sinecatéchines sont plus sécuritaires, mais ils prennent plus de temps pour traiter, ce qui influencent grandement la compliance. Certains articles proposent la combinaison entre la crème d'imiquimod et un inhibiteur IL-10, ou des peptides naturelles (provenant de grenouilles/crapauds) ou d'un vaccin thérapeutique afin d'augmenter l'efficacité du traitement.
La vaccination post-infection n'a pas démontré de bénéfice pour diminuer ou éliminer les lésions[16][19][20].
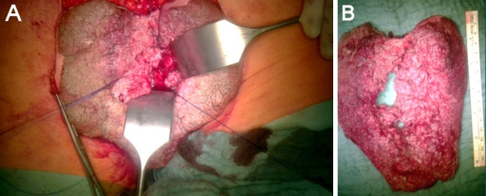
Chirurgical
Pour les lésions réfractaires au traitement et pour les pathologies avancées, on peut procéder à l'exérèse chirurgicale. Seules les thérapies chirurgicales ont des taux de résolution proches de 100%. Les options proposées sont les suivantes [3][16][21]:
- l'électrochirurgie
- le curettage
- l'excision aux ciseaux
- la thérapie au laser
- l'exérèse en plan total avec fermeture primaire ou lambeau d'avancement pour couvrir de larges zones atteintes.
Complications
Les complications de cette maladie sont [3][21] :
- des lésions précancéreuses
- le cancer de l'anus[note 3]
- le cancer du col de l'utérus
- le cancer du pénis
- le cancer de la vulve
- des effets psychologiques importants (ex. l'anxiété, la culpabilité et la colère)
- des inquiétudes concernant la perte de fertilité et le cancer.
Évolution
Cette maladie est curable, mais le condylome acuminé peut être difficilement traitable. En effet, les lésions peuvent nécessiter plusieurs traitements ou une combinaison de traitements au fil du temps. Il peut même réapparaître après tous les types de traitement, mais l'exérèse chirurgicale est la meilleure option pour viser un taux de réussite proche de 100%. La récidive des lésions après la clairance est observée 20 à 30 % du temps. [3][21]
| Taux d'élimination (%) | Taux de récidive (%) | |
|---|---|---|
| Podophyllotoxine | 45 à 83 | 6 à 100 |
| Imiquimod | 35 à 68 | 6 à 26 |
| Pommade aux sinecatéchines | 47 à 59 | 7 à 11 |
| Cryothérapie | 44 à 75 | 21 à 42 |
| Acide trichloracétique | 65 à 81 | 36 |
L'infection par plusieurs souches de VPH provoque également une dysplasie cellulaire conduisant à certains cancers, notamment le cancer du col de l'utérus chez la femme et, chez l'homme, le cancer du pénis ou du rectum. Les types de VPH 16 et 18 sont des souches à haut risque de développer une tumeur maligne. La recherche a solidement établi leur rôle dans le développement des carcinomes cervicaux, anogénitaux et oraux. Les types de VPH 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68, 73 et 82 peuvent également être présents dans le cancer des muqueuses. [1][6][3][note 4]
Prévention
Afin de prévenir la transmission, les médecins doivent expliquer aux patients la nature de leur lésions. Le patient doit être avisé d'informer tous ses partenaires sexuels actuels et antérieurs au cours des six derniers mois (avant l'apparition de la verrue génitale). Les patients doivent être informés de l'importance de l'utilisation du préservatif, car il a été démontré qu'il protège contre l'infection par le VPH, qui provoque des verrues génitales.[21] L'utilisation du préservatif peut également prévenir la transmission d'autres maladies transmissibles.[3] L'éducation des patients sur les avantages du vaccin contre le VPH est primordiale. L'infection au VPH est évitable grâce à un vaccin très efficace. Ce vaccin protège contre les souches de VPH 6 et 11. Le vaccin protège également contre les souches virales qui causent le cancer du col de l'utérus, y compris le VPH 16 et le VPH 18.[22] Le vaccin contre le VPH est plus efficace lorsqu'il est administré avant l'exposition au virus. Par conséquent, les recommandations actuelles sont que les filles et les garçons âgés de 9 à 11 ans reçoivent deux doses du vaccin, une en 4e année du primaire et l'autre en 3e année du secondaire.[23] Il est également recommandé à toute personne de moins de 26 ans de se faire vacciner.[24][3]
Enfin, le patient doit recevoir une formation sur les pratiques sexuelles sans risque ; cela signifie d'utiliser une barrière de protection, éviter les relations sexuelles anales et les partenaires multiples. Le patient doit être encouragé à se faire tester pour d'autres infections sexuellement transmissibles et à maintenir un suivi à long terme.[3]
Notes
- ↑ Si une grosse masse tumorale occupe toute la zone anogénitale, les tumeurs de Buschke-Lowenstein doivent être un diagnostic envisagé. Ces tumeurs sont une complication maligne du condylome acuminé.
- ↑ Cette combinaison s'est avérée plus simple, plus efficace et a des taux de récidive plus faibles que le traitement au laser CO2. Elle peut être un adjuvant utile à d'autres modalités de traitement traditionnelles.
- ↑ Rechercher les signes tels que les saignements, la pigmentation irrégulière, l'ulcération cutanée et les lésions avec infiltration cutanée palpable.
- ↑ La maladie de Bowen a des corrélations avec les types de VPH 16, 18, 31, 32 et 34. L'épidermodysplasie verruciforme a été liée à Types de VPH 5, 8, 9, 12, 14, 15, 17, 19-25, 36-38, 46, 47, 49 et 50.
Références
- Cette page a été modifiée ou créée le 2023/02/03 à partir de Condyloma Acuminata (StatPearls / Condyloma Acuminata (2022/08/01)), écrite par les contributeurs de StatPearls et partagée sous la licence CC-BY 4.0 international (jusqu'au 2022-12-08). Le contenu original est disponible à https://www.ncbi.nlm.nih.gov/pubmed/31613447 (livre).
- ↑ 1,0 1,1 1,2 et 1,3 Reto Kaderli, Beat Schnüriger et Lukas E. Brügger, « The impact of smoking on HPV infection and the development of anogenital warts », International Journal of Colorectal Disease, vol. 29, no 8, , p. 899–908 (ISSN 1432-1262, PMID 24935346, DOI 10.1007/s00384-014-1922-y, lire en ligne)
- ↑ 2,0 et 2,1 Ina U. Park, Camille Introcaso et Eileen F. Dunne, « Human Papillomavirus and Genital Warts: A Review of the Evidence for the 2015 Centers for Disease Control and Prevention Sexually Transmitted Diseases Treatment Guidelines », Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America, vol. 61 Suppl 8, , S849–855 (ISSN 1537-6591, PMID 26602622, DOI 10.1093/cid/civ813, lire en ligne)
- ↑ 3,00 3,01 3,02 3,03 3,04 3,05 3,06 3,07 3,08 3,09 3,10 3,11 3,12 3,13 3,14 3,15 et 3,16 Keith B. Pennycook et Tess A. McCready, StatPearls, StatPearls Publishing, (PMID 31613447, lire en ligne)
- ↑ A. B. Fleischer, C. A. Parrish, R. Glenn et S. R. Feldman, « Condylomata acuminata (genital warts): patient demographics and treating physicians », Sexually Transmitted Diseases, vol. 28, no 11, , p. 643–647 (ISSN 0148-5717, PMID 11677386, DOI 10.1097/00007435-200111000-00006, lire en ligne)
- ↑ 5,0 et 5,1 (en) Erich V. Kliewer, Alain A. Demers, Lawrence Elliott et Robert Lotocki, « Twenty-Year Trends in the Incidence and Prevalence of Diagnosed Anogenital Warts in Canada », Sexually Transmitted Diseases, vol. 36, no 6, , p. 380–386 (ISSN 0148-5717, DOI 10.1097/OLQ.0b013e318198de8c, lire en ligne)
- ↑ 6,0 et 6,1 Pina Brianti, Eduardo De Flammineis et Santo Raffaele Mercuri, « Review of HPV-related diseases and cancers », The New Microbiologica, vol. 40, no 2, , p. 80–85 (ISSN 1121-7138, PMID 28368072, lire en ligne)
- ↑ Selina Varma, Eva Lathrop et Lisa B. Haddad, « Pediatric condyloma acuminata », Journal of Pediatric and Adolescent Gynecology, vol. 26, no 6, , e121–122 (ISSN 1873-4332, PMID 24001431, DOI 10.1016/j.jpag.2013.03.017, lire en ligne)
- ↑ 8,0 8,1 8,2 et 8,3 Miguel Costa-Silva, Inês Fernandes, Acácio Gonçalves Rodrigues et Carmen Lisboa, « Anogenital warts in pediatric population », Anais Brasileiros De Dermatologia, vol. 92, no 5, , p. 675–681 (ISSN 1806-4841, PMID 29166505, Central PMCID 5674701, DOI 10.1590/abd1806-4841.201756411, lire en ligne)
- ↑ (en) R Maw et on behalf of the HPV Special Interest Group of BASHH, « Anogenital warts », Sexually Transmitted Infections, vol. 82, no suppl_4, , iv40–iv41 (ISSN 1368-4973, PMID 17151053, Central PMCID PMC2563897, DOI 10.1136/sti.2006.023226, lire en ligne)
- ↑ Sasha J. Betz, « HPV-Related Papillary Lesions of the Oral Mucosa: A Review », Head and Neck Pathology, vol. 13, no 1, , p. 80–90 (ISSN 1936-0568, PMID 30693456, Central PMCID 6405797, DOI 10.1007/s12105-019-01003-7, lire en ligne)
- ↑ N. L. Sykes, « Condyloma acuminatum », International Journal of Dermatology, vol. 34, no 5, , p. 297–302 (ISSN 0011-9059, PMID 7541783, DOI 10.1111/j.1365-4362.1995.tb03607.x, lire en ligne)
- ↑ A. Ferenczy, C. Bergeron et R. M. Richart, « Human papillomavirus DNA in fomites on objects used for the management of patients with genital human papillomavirus infections », Obstetrics and Gynecology, vol. 74, no 6, , p. 950–954 (ISSN 0029-7844, PMID 2555753, lire en ligne)
- ↑ C. O'Mahony, M. Gomberg, M. Skerlev et A. Alraddadi, « Position statement for the diagnosis and management of anogenital warts », Journal of the European Academy of Dermatology and Venereology: JEADV, vol. 33, no 6, , p. 1006–1019 (ISSN 1468-3083, PMID 30968980, Central PMCID 6593709, DOI 10.1111/jdv.15570, lire en ligne)
- ↑ M. Sporkert et A. Rübben, « [Buschke-Lowenstein tumors] », Der Hautarzt; Zeitschrift Fur Dermatologie, Venerologie, Und Verwandte Gebiete, vol. 68, no 3, , p. 199–203 (ISSN 1432-1173, PMID 28074214, DOI 10.1007/s00105-016-3924-x, lire en ligne)
- ↑ Jianwei Yuan, Guoying Ni, Tianfang Wang et Kate Mounsey, « Genital warts treatment: Beyond imiquimod », Human Vaccines & Immunotherapeutics, vol. 14, no 7, , p. 1815–1819 (ISSN 2164-5515, PMID 29505317, Central PMCID PMC6067868, DOI 10.1080/21645515.2018.1445947, lire en ligne)
- ↑ 16,0 16,1 et 16,2 (en) « Sexually Transmitted Infections Treatment Guidelines, 2021 : Anogenital warts », sur CDC Centers for Disease Control and Prevention, (consulté le 28 février 2022)
- ↑ (en) Jianwei Yuan, Guoying Ni, Tianfang Wang et Kate Mounsey, « Genital warts treatment: Beyond imiquimod », Human Vaccines & Immunotherapeutics, vol. 14, no 7, , p. 1815–1819 (ISSN 2164-5515 et 2164-554X, PMID 29505317, Central PMCID PMC6067868, DOI 10.1080/21645515.2018.1445947, lire en ligne)
- ↑ (en) J.M. Jung, C.J. Jung, W.J. Lee et C.H. Won, « Topically applied treatments for external genital warts in nonimmunocompromised patients: a systematic review and network meta‐analysis », British Journal of Dermatology, vol. 183, no 1, , p. 24–36 (ISSN 0007-0963 et 1365-2133, DOI 10.1111/bjd.18638, lire en ligne)
- ↑ (en) Richard Gilson, Diarmuid Nugent, Kate Bennett et Caroline J Doré, « Imiquimod versus podophyllotoxin, with and without human papillomavirus vaccine, for anogenital warts: the HIPvac factorial RCT », Health Technology Assessment, vol. 24, no 47, , p. 1–86 (ISSN 1366-5278 et 2046-4924, PMID 32975189, Central PMCID PMC7548868, DOI 10.3310/hta24470, lire en ligne)
- ↑ Hoon Choi, « Can quadrivalent human papillomavirus prophylactic vaccine be an effective alternative for the therapeutic management of genital warts? an exploratory study », International braz j urol, vol. 45, no 2, , p. 361–368 (ISSN 1677-6119 et 1677-5538, PMID 30785696, Central PMCID PMC6541142, DOI 10.1590/s1677-5538.ibju.2018.0355, lire en ligne)
- ↑ 21,0 21,1 21,2 21,3 et 21,4 C. J. N. Lacey, S. C. Woodhall, A. Wikstrom et J. Ross, « 2012 European guideline for the management of anogenital warts », Journal of the European Academy of Dermatology and Venereology: JEADV, vol. 27, no 3, , e263–270 (ISSN 1468-3083, PMID 22409368, DOI 10.1111/j.1468-3083.2012.04493.x, lire en ligne)
- ↑ P. E. Castle et M. Maza, « Prophylactic HPV vaccination: past, present, and future », Epidemiology and Infection, vol. 144, no 3, , p. 449–468 (ISSN 1469-4409, PMID 26429676, DOI 10.1017/S0950268815002198, lire en ligne)
- ↑ « Admissibilité – Programme de vaccination contre les infections par les virus du papillome humain (VPH) », sur Gouvernement du Québec, (consulté le 17 février 2023)
- ↑ Daniel C. Beachler, Felisa A. Gonzales, Sarah C. Kobrin et Aimée R. Kreimer, « HPV vaccination initiation after the routine-recommended ages of 11-12 in the United States », Papillomavirus Research (Amsterdam, Netherlands), vol. 2, , p. 11–16 (ISSN 2405-8521, PMID 26783559, Central PMCID 4714353, DOI 10.1016/j.pvr.2015.12.001, lire en ligne)
