« Carcinome canalaire in situ » : différence entre les versions
Aucun résumé des modifications |
(Correction SNOMED ID) |
||
| (54 versions intermédiaires par 4 utilisateurs non affichées) | |||
| Ligne 1 : | Ligne 1 : | ||
{{Information maladie | {{Information maladie | ||
| acronyme = CCIS | | acronyme = CCIS | ||
| image = | | image = Breast cancer ductal carcinoma in situ.jpg | ||
| description_image = | | description_image = Cancer canalaire in situ | ||
| wikidata_id = | | wikidata_id = Q337585 | ||
| autres_noms = | | autres_noms = Carcinome intracanalaire | ||
| terme_anglais = Ductal Carcinoma in Situ | | terme_anglais = Ductal Carcinoma in Situ | ||
| | | spécialités = Chirurgie générale, Radiologie, Oncologie, Radio-oncologie | ||
| | | révision_par_le_comité_éditorial = Sujet:Wmodakdsesi2ud6n | ||
| | | révision_par_le_comité_éditorial_date = 2022-11-30 | ||
| | | snomed_ct_id = 1162814007 | ||
}} | }} | ||
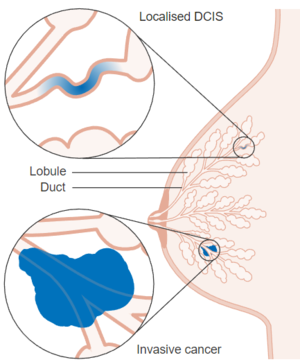
Le carcinome canalaire in situ (CCIS), également appelé carcinome intracanalaire, est un cancer du sein non invasif caractérisé par une prolifération de cellules épithéliales anormales confinées dans la membrane basale. | Le '''carcinome canalaire in situ''' (CCIS), également appelé carcinome intracanalaire, est un cancer du sein non invasif caractérisé par une prolifération néoplasique de cellules épithéliales anormales confinées dans la membrane basale du système canalo-lobulaire mammaire. Le CCIS se présente par une atypie cytologique subtile qui ne progresse pas nécessairement vers un cancer du sein invasif.<ref name=":2">{{Citation d'un article|prénom1=Puay Hoon|nom1=Tan|prénom2=Ian|nom2=Ellis|prénom3=Kimberly|nom3=Allison|prénom4=Edi|nom4=Brogi|titre=The 2019 World Health Organization classification of tumours of the breast|périodique=Histopathology|volume=77|numéro=2|date=2020-08|issn=1365-2559|pmid=32056259|doi=10.1111/his.14091|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/32056259/|consulté le=2022-05-08|pages=181–185}}</ref><ref name=":0">{{Citation d'un ouvrage|prénom1=Sandra|nom1=Tomlinson-Hansen|prénom2=Myra|nom2=Khan|prénom3=Sebastiano|nom3=Cassaro|titre=StatPearls|éditeur=StatPearls Publishing|date=2022|pmid=33620843|lire en ligne=http://www.ncbi.nlm.nih.gov/books/NBK567766/|consulté le=2022-04-29}}</ref> | ||
Le CCIS est classé comme Tis et correspond à un cancer du sein de stade 0. | |||
==Épidémiologie== | ==Épidémiologie== | ||
Le cancer du sein est le cancer le plus fréquent chez les femmes au Québec. Chez les femmes âgées de 50 à 64 ans, le risque de | Le cancer du sein est le cancer le plus fréquent chez les femmes au Québec. Chez les femmes âgées de 50 à 64 ans, le risque de CCIS peut atteindre 88 pour 100 000 femmes.<ref name=":4">{{Citation d'un article|prénom1=Karla|nom1=Kerlikowske|titre=Epidemiology of ductal carcinoma in situ|périodique=Journal of the National Cancer Institute. Monographs|volume=2010|numéro=41|date=2010|issn=1745-6614|pmid=20956818|pmcid=5161058|doi=10.1093/jncimonographs/lgq027|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/20956818/|consulté le=2022-05-08|pages=139–141}}</ref> Aujourd'hui, 20 % à 25 % des cancers du sein diagnostiqués aux États-Unis sont des CCIS. Cela a augmenté parallèlement à l'utilisation de la mammographie de dépistage, car un pourcentage important de CCIS est identifié pour la première fois lors de la mammographie de dépistage. À l'ère de la mammographie de pré-dépistage, moins de 5 % des cancers du sein nouvellement diagnostiqués étaient des CCIS.<ref name=":0" /> | ||
'' | Selon l'Institut national de santé publique du Québec, le taux de détection des CCIS entre 2002 et 2015 variait entre 1,0 et 1,5 pour 1 000 femmes participant au Programme québécois de dépistage du cancer du sein<ref name=":12" />. Les CCIS représentaient environ 20 % de tous les cancers du sein détectés<ref name=":12">{{Citation d'un lien web|langue=français|titre=Portrait des carcinomes canalaires in situ dans le Programme québécois de dépistage du cancer du sein|url=https://www.inspq.qc.ca/sites/default/files/publications/2411_carcinomes_canalaires_in_situ_programme_quebecois_depistage_cancer_sein.pdf|site=INSPQ.qc.ca|date=2018|consulté le=25 avril 2022}}</ref>. | ||
==Étiologies== | ==Étiologies== | ||
L'évolution du tissu mammaire normal en | L'évolution du tissu mammaire normal en CCIS est {{Étiologie|nom=étiologie inconnue|principale=1|affichage=inconnue}}. | ||
Les hormones jouent un rôle important dans le développement du cancer. Le temps d'exposition aux oestrogènes est lié au développement du CCIS. Il a aussi été prouvé que les oestrogènes et ses métabolites ainsi que d'autres hormones stéroïdiennes comme la progestérone ont tous un effet sur le développement et l'évolution de certains cancer du sein. Ces cancers ont une meilleure réponse au traitement.<ref name=":13">{{Citation d'un ouvrage|langue=anglais|auteur1=Brunicardi F, & Andersen D.K., & Billiar T.R., & Dunn D.L., & Kao L.S., & Hunter J.G., & Matthews J.B., & Pollock R.E.(Eds.),Eds. F. Charles Brunicardi, et al.|titre=Schwartz's Principles of Surgery|passage=Chapter 17|lieu=United States|éditeur=McGraw-Hill Education|date=2019|pages totales=2448|isbn=1259835359|lire en ligne=}}</ref> | |||
==Physiopathologie== | ==Physiopathologie== | ||
Le | Le CCIS est une prolifération clonale de cellules épithéliales dans l'unité canalo-lobulaire du sein confinée à la membrane basale des cellules myoépithéliales. Ce confinement à la couche de cellules myoépithéliales la démarque du carcinome mammaire invasif. | ||
On peut voir le CCIS comme faisant partie d'un spectrum de modification des cellules canalaires débutant par des modifications bénignes qui sont le produit du développement du sein et de l'involution. Certaines sont prolifératives alors que d'autres non. Ces processus peuvent se transformer à leur tour en atypies ou en processus malin<ref name=":13" />. | |||
De manière générale, une hyperplasie canalaire atypique est la première étape vers le CCIS. Celle-ci apparaitra comme une lésion de CCIS de bas grade avec des présentations histologiques similaires au CCIS mesurant entre 2 et 3 mm. Si la lésion atteint plus de 3 mm, elle sera considérée comme un CCIS<ref name=":13" />.[[Fichier:Carcinome canalaire in situ.png|vignette|CCIS (DCIS en anglais) vs cancer invasif]] | |||
==Présentation clinique== | ==Présentation clinique== | ||
===Facteurs de risque=== | ===Facteurs de risque=== | ||
Les facteurs de risque du cancer du sein | Les facteurs de risque du CCIS sont les mêmes que pour le cancer du sein invasif <ref name=":0" /><ref name=":6">{{Citation d'un article|prénom1=Rebecca|nom1=Siegel|prénom2=Jiemin|nom2=Ma|prénom3=Zhaohui|nom3=Zou|prénom4=Ahmedin|nom4=Jemal|titre=Cancer statistics, 2014|périodique=CA: a cancer journal for clinicians|volume=64|numéro=1|date=2014-01|issn=1542-4863|pmid=24399786|doi=10.3322/caac.21208|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/24399786/|consulté le=2022-05-08|pages=9–29}}</ref><ref name=":7">{{Citation d'un article|prénom1=Rowan T.|nom1=Chlebowski|prénom2=Garnet L.|nom2=Anderson|prénom3=Margery|nom3=Gass|prénom4=Dorothy S.|nom4=Lane|titre=Estrogen plus progestin and breast cancer incidence and mortality in postmenopausal women|périodique=JAMA|volume=304|numéro=15|date=2010-10-20|issn=1538-3598|pmid=20959578|pmcid=5142300|doi=10.1001/jama.2010.1500|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/20959578/|consulté le=2022-05-08|pages=1684–1692}}</ref><ref name=":3">{{Citation d'un article|prénom1=Michael|nom1=Co|prénom2=Andrea|nom2=Lee|prénom3=Ava|nom3=Kwong|titre=Non-surgical treatment for ductal carcinoma in situ of the breasts - a prospective study on patient's perspective|périodique=Cancer Treatment and Research Communications|volume=26|date=2021|issn=2468-2942|pmid=33340904|doi=10.1016/j.ctarc.2020.100241|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/33340904/|consulté le=2022-04-29|pages=100241}}</ref>: | ||
* Âge | * l'{{Facteur de risque|nom=Âge avancé|affichage=âge avancé}} | ||
* Exposition | * la {{Facteur de risque|nom=Âge avancé|affichage=prédisposition génétique}} ({{Facteur de risque|nom=BRCA1|affichage=BRCA1}} et {{Facteur de risque|nom=BRCA2|affichage=BRCA2}}) | ||
* l'{{Facteur de risque|nom=Exposition aux oestrogènes exogènes|affichage=exposition aux oestrogènes exogènes}} (dont les {{Facteur de risque|nom=traitement hormonal substitutif|affichage=traitements hormonaux substitutifs}} chez les femmes ménopausées et l'utilisation de {{Facteur de risque|nom=contraceptifs oraux combinés|affichage=contraceptifs oraux combinés}}) | |||
* l'{{Facteur de risque|nom=exposition aux oestrogènes endogènes|affichage=exposition aux oestrogènes endogènes}}<ref group="note">Approximé par l'âge à la ménarche, l'âge à la ménopause et l'âge du premier accouchement à terme, le nombre de grossesse</ref> | |||
* | * la {{Facteur de risque|nom=consommation d'alcool|affichage=consommation d'alcool}} | ||
* | * les {{Facteur de risque|nom=antécédents familiaux de cancer du sein des parents du premier degré|affichage=antécédents familiaux de cancer du sein des parents du premier degré}} | ||
* les {{Facteur de risque|nom=antécédents familiaux de cancer|affichage=antécédents familiaux de cancer}} | |||
* la {{Facteur de risque|nom=Maladie de Paget mammaire|affichage=maladie de Paget mammaire}} | |||
* l'{{Facteur de risque|nom=hyperplasie canalaire atypique|affichage=hyperplasie canalaire atypique}}. | |||
===Questionnaire=== | ===Questionnaire=== | ||
Cette maladie est généralement {{Symptôme|nom=asymptomatique|affichage=asymptomatique|prévalence=90}} : 90% de tous les cas de CCIS sont détectés à partir de mammographies de dépistage<ref name=":10">{{Citation d'un article|prénom1=D. D.|nom1=Dershaw|prénom2=A.|nom2=Abramson|prénom3=D. W.|nom3=Kinne|titre=Ductal carcinoma in situ: mammographic findings and clinical implications|périodique=Radiology|volume=170|numéro=2|date=1989-02|issn=0033-8419|pmid=2536185|doi=10.1148/radiology.170.2.2536185|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/2536185/|consulté le=2022-05-08|pages=411–415}}</ref> . De nombreuses femmes se présentent pour un examen des seins après qu'une anomalie ait été décelée lors des mammographies de dépistage. | |||
Si la lésion est péri-aréolaire, elle peut donner un {{Symptôme|nom=écoulement mamelonnaire|affichage=écoulement mamelonnaire}}. Il peut y avoir un effet de {{Symptôme|nom=masse mammaire|affichage=masse}} perceptible chez certaines formes de CCIS extensifs. | |||
On questionnera aussi la patiente pour ses {{Élément d'histoire|nom=antécédents d'imagerie mammaire antérieure|affichage=antécédents d'imagerie}} ou de {{Élément d'histoire|nom=antécédents de biopsies mammaires antérieures|affichage=biopsies mammaires antérieures}}. | |||
===Examen clinique=== | |||
{{Encart | |||
| contenu = Il peut y avoir une gamme de résultats à l'examen physique allant de changements évidents à aucun changement mammaire perceptible. | |||
| type = confirmation | |||
}} | |||
L'examen clinique regroupera les éléments suivants : | |||
* à l'{{Examen clinique|nom=examen mammaire}}, on peut retrouver les éléments suivants<ref name=":0" /> : | |||
**le plus souvent, l'{{Signe clinique|nom=examen mammaire normal|affichage=examen mammaire est normal}} | |||
* à l'{{Examen clinique|nom= | **des changements cutanés suggestifs d'une {{Signe clinique|nom=maladie de Paget mammaire|affichage=maladie de Paget mammaire}} | ||
**{{Signe clinique|nom= | ** un {{Signe clinique|nom=Écoulement mammaire (signe clinique)|affichage=écoulement mammaire}} unicanalaire (eau de roche ou sanguinolent) | ||
** {{Signe clinique|nom= | **une {{Signe clinique|nom=masse mammaire}}(rare). | ||
** {{Signe clinique|nom= | * l'{{Examen clinique|nom=examen des aires ganglionnaires}} | ||
**{{Signe clinique|nom= | ** il n'y a pas d'adénopathie dans le CCIS ; toute adénopathie est en faveur d'un cancer invasif. | ||
==Examens paracliniques== | ==Examens paracliniques== | ||
{| class="wikitable" | |||
|+ | |||
**{{Signe paraclinique|nom= | Modalités diagnostiques du CCIS | ||
!Modalité | |||
!Explications | |||
|- | |||
* {{Examen paraclinique|nom=Biopsie au trocart|indication=pour le diagnostic histologique}} | !{{Examen paraclinique|nom=Mammographie de dépistage|indication=Indication}}<ref name=":11">{{Citation d'un article|prénom1=R.|nom1=Holland|prénom2=J. H.|nom2=Hendriks|prénom3=A. L.|nom3=Vebeek|prénom4=M.|nom4=Mravunac|titre=Extent, distribution, and mammographic/histological correlations of breast ductal carcinoma in situ|périodique=Lancet (London, England)|volume=335|numéro=8688|date=1990-03-03|issn=0140-6736|pmid=1968538|doi=10.1016/0140-6736(90)90747-s|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/1968538/|consulté le=2022-05-08|pages=519–522}}</ref> | ||
* | | | ||
** statut des récepteurs hormonaux - en particulier le statut des récepteurs des œstrogènes (ER), des récepteurs de la progestérone (PR) et du récepteur du facteur de croissance épidermique humain 2 (HER-2)<ref name=":0" /> | * Forte sensibilité, faible spécificité. | ||
* | *'''Une mammographie de dépistage s'effectue chez les patientes asymptomatiques.''' En présences d'anomalies suggestives d'un CCIS, la patiente sera redirigée vers son médecin traitant pour un examen physique complet et pour des compléments d'investigations. | ||
Il est à noter que même la biopsie au trocart a des limites. | * Si la patiente a été référée avec une lésion suspecte lors d'une mammographie de dépistage, il est important d'effectuer une mammographie diagnostique pour caractériser la maladie ipsilatérale et exclure une maladie bilatérale. | ||
*Les {{Signe paraclinique|nom=microcalcifications|affichage=microcalcifications}} sous forme de {{Signe paraclinique|nom=ramifications linéaires|affichage=ramifications linéaires}}, de {{Signe paraclinique|nom=calcifications pléomorphes|affichage=calcifications pléomorphes}} ou de {{Signe paraclinique|nom=macrocalcifications groupées|affichage=macrocalcifications groupées}}. Les microcalcifications sont un signe particulièrement important de cancer (50% des cancers non palpables). Pour certaines femmes, notamment chez les jeunes femmes, il peut s'agir de la seule anomalie mammographique. Les autres signes paracliniques possibles sont la {{Signe paraclinique|nom=Masse solide|affichage=masse solide}} et {{Signe paraclinique|nom=Épaississement des tisssus mammaires|affichage=épaississement des tisssus mammaires}}. Les calcifications associées à la malignité ont tendance à être plus petites (0,1 à 1 mm de diamètre) et sont généralement groupées. | |||
|- | |||
!{{Examen paraclinique|nom=Mammographie diagnostique|indication=Une fois les calcifications suspectes identifiées lors de la mammographie de dépistage}} | |||
| | |||
* La mammographie diagnostique est utilisée lorsqu'il y a des symptômes (masse mammaire ou écoulement). Elle utilise des vues supplémentaires.<ref name=":13" /> | |||
**Clichés compressifs<ref group="note">Dispositif de compression placé directement sur une anomalie mammographique identifiée cachée par des tissus</ref> : minimise l'artéfact de mouvement, améliore la définition, sépare les tissus et diminue le rayonnement nécessaire pour pénétrer dans le sein. | |||
**Clichés magnifiés <ref group="note">Techniques de grossissement (×1,5) souvent associées à la compression ponctuelle pour mieux visualiser les calcifications et les marges des masses.</ref>: permet d'agrandir les calcifications pour une meilleure analyse de leur forme, leur distribution et leur nombre. | |||
|- | |||
!{{Examen paraclinique|nom=Tomosynthèse mammaire}} | |||
| | |||
* Prend des images en 3D. Alternative à la mammographie 2D standard qui est limitée par la superposition du parenchyme mammaire et de la densité mammaire qui obscurcit les cancers ou rend suspectes les structures normales. | |||
|- | |||
!{{Examen paraclinique|nom=Imagerie par résonnance magnétique mammaire|affichage=IRM mammaire}} | |||
| | |||
* Détecte des lésions supplémentaires en complément à la mammographie, pouvant avoir un impact sur la prise en charge. | |||
* Indications fréquentes d'utiliser l'IRM : | |||
** Forts antécédents familiaux de cancer du sein ou porteuses de mutations génétiques connues (BRCA) : ces patientes nécessitent un dépistage à un âge précoce et la mammographie est limitée par la densité mammaire accrue en jeune âge. | |||
** Évaluation pré-opératoire | |||
** Évaluation du sein controlatéral chez les femmes ayant un cancer du sein connu | |||
** Métastase ganglionnaire d'un cancer du sein sans tumeur primitive identifiable | |||
** Évaluation pour les techniques d'irradiation partielle du sein | |||
** Évaluation de récidive tumorale du sein traité. | |||
* Une anomalie notée à l'IRM qui n'est pas visible à la mammographie nécessite un examen échographique ciblé ou une biopsie. | |||
|- | |||
!{{Examen paraclinique|nom=Biopsie au trocart|indication=pour le diagnostic histologique}} | |||
| | |||
* Permet de prélever plus de tissus par rapport à l'aspiration à l'aiguille fine et de différencier entre CCIS et cancer du sein invasif. | |||
* La biopsie au trocart ou au mammotome est habituellement faite sous stéréotaxie, car la lésion est visible par mammographie seulement. | |||
* Un clip métallique sera laissé en place lors de la procédure pour localiser le site exact de l'origine du prélèvement et orienter le chirurgien. | |||
* Identification du statut des récepteurs hormonaux - en particulier le statut des récepteurs des œstrogènes (ER), des récepteurs de la progestérone (PR) et du récepteur du facteur de croissance épidermique humain 2 (HER-2)<ref name=":0" /> | |||
* Il est à noter que même la biopsie au trocart a des limites. Environ 10 % à 20 % des lésions CCIS diagnostiquées sur biopsie au trocart deviendront un cancer invasif après résection définitive. En outre, les grandes lésions CCIS de haut grade ont une probabilité plus élevée de contenir un composant invasif.<ref name=":17">{{Citation d'un article|prénom1=Nehmat|nom1=Houssami|prénom2=Stefano|nom2=Ciatto|prénom3=Ian|nom3=Ellis|prénom4=Daniela|nom4=Ambrogetti|titre=Underestimation of malignancy of breast core-needle biopsy: concepts and precise overall and category-specific estimates|périodique=Cancer|volume=109|numéro=3|date=2007-02-01|issn=0008-543X|pmid=17186530|doi=10.1002/cncr.22435|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/17186530/|consulté le=2022-05-08|pages=487–495}}</ref><ref name=":0" /> | |||
|} | |||
===Histopathologie=== | ===Histopathologie=== | ||
Les canaux mammaires normaux se terminent par une unité lobulaire terminale (TDLU). Le conduit se termine par des lobules constitués de petites structures glandulaires appelées acini. Il existe une bicouche de cellules tapissant le système canalo-lobulaire constitué de cellules épithéliales luminales internes et de cellules myoépithéliales luminales externes. La majorité des lésions mammaires (bénignes ou malignes) se développent dans le TDLU.<ref name=":0" /> | Les canaux mammaires normaux se terminent par une unité lobulaire terminale (TDLU). Le conduit se termine par des lobules constitués de petites structures glandulaires appelées acini. Il existe une bicouche de cellules tapissant le système canalo-lobulaire constitué de cellules épithéliales luminales internes et de cellules myoépithéliales luminales externes. La majorité des lésions mammaires (bénignes ou malignes) se développent dans le TDLU.<ref name=":0" /> | ||
Des immunocolorations peuvent être effectuées pour montrer la rétention des cellules myoépithéliales, telles que la cytokératine 5/6, la myosine des muscles lisses et la p63. Histologiquement, le CCIS est classé selon les caractéristiques de l''''architecture, le grade nucléaire et/ou la présence de nécrose'''.<ref name=":0" /> | Des immunocolorations peuvent être effectuées pour montrer la rétention des cellules myoépithéliales, telles que la cytokératine 5/6, la myosine des muscles lisses et la p63. Histologiquement, le CCIS est classé selon les caractéristiques de l''''architecture, le grade nucléaire''' (grade de Nottingham) '''et/ou la présence de nécrose'''.<ref name=":0" /> | ||
{| class="wikitable" | |||
|+Type de motifs architecturaux | |||
! | |||
!Caractéristiques | |||
!Grade | |||
|- | |||
!{{Signe paraclinique|nom=Comédonécrose}} | |||
|Les cellules malignes au centre du canal subissent une nécrose, parfois avec des calcifications<ref group="note">La comédonécrose est souvent décrite pour caractériser certains CCIS mais ne confère pas de grade ni d'architecture spécifique à la lésion. Il n'y a pas de consensus dans la littérature sur la quantité de nécrose centrale nécessaire pour qualifier une lésion de bas ou haut grade.</ref><ref>{{Citation d'un article|langue=en|prénom1=Sarah E.|nom1=Pinder|titre=Ductal carcinoma in situ (DCIS): pathological features, differential diagnosis, prognostic factors and specimen evaluation|périodique=Modern Pathology|volume=23|numéro=2|date=2010-05|issn=1530-0285|doi=10.1038/modpathol.2010.40|lire en ligne=https://www.nature.com/articles/modpathol201040|consulté le=2022-05-08|pages=S8–S13}}</ref>. | |||
|Non défini | |||
|- | |||
!{{Signe paraclinique|nom=Motif cribiforme}} | |||
|Les cellules tumorales remplissent le canal et forment des pseudo-lumières qui apparaissent comme des espaces perforés. | |||
|Bas | |||
|- | |||
!{{Signe paraclinique|nom=Motif micropapillaire}} | |||
|Les cellules en prolifération forment des touffes en forme de massue et se projettent dans la lumière du canal sans noyau fibrovasculaire | |||
|Bas | |||
|- | |||
!{{Signe paraclinique|nom=Motif papillaire}} | |||
|Les cellules prolifèrent autour des noyaux fibrovasculaires | |||
|Haut | |||
|- | |||
!{{Signe paraclinique|nom=Masse solide}} | |||
|Les cellules remplissent et dilatent le conduit | |||
|Haut | |||
|} | |||
Les CCIS avec des caractéristiques solides ou comédoniennes sont considérés comme des lésions de haut grade et les CCIS de haut grade ont plus tendance à se développer en carcinome invasif. Il est courant de voir plusieurs modèles architecturaux dans le CCIS. <ref name=":8">{{Citation d'un article|prénom1=Claudia|nom1=Stanciu-Pop|prénom2=Marie-Cécile|nom2=Nollevaux|prénom3=Martine|nom3=Berlière|prénom4=Francois P.|nom4=Duhoux|titre=Morphological intratumor heterogeneity in ductal carcinoma in situ of the breast|périodique=Virchows Archiv: An International Journal of Pathology|volume=479|numéro=1|date=2021-07|issn=1432-2307|pmid=33502600|doi=10.1007/s00428-021-03040-6|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/33502600/|consulté le=2022-05-08|pages=33–43}}</ref><ref name=":0" /> | |||
Le CCIS est classé en trois grades nucléaires désignés comme faible, intermédiaire ou élevé. Le CCIS avec un grade nucléaire élevé a plus de chances de se développer en carcinome du sein invasif.<ref name=":9">{{Citation d'un article|prénom1=Bruno|nom1=Cutuli|prénom2=Claire|nom2=Lemanski|prénom3=Brigitte|nom3=De Lafontan|prénom4=Marie-Pierre|nom4=Chauvet|titre=Ductal Carcinoma in Situ: A French National Survey. Analysis of 2125 Patients|périodique=Clinical Breast Cancer|volume=20|numéro=2|date=2020-04|issn=1938-0666|pmid=31780381|doi=10.1016/j.clbc.2019.08.002|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/31780381/|consulté le=2022-05-08|pages=e164–e172}}</ref><ref name=":0" /> | |||
Le CCIS est classé en trois grades nucléaires désignés comme faible, intermédiaire ou élevé. Le CCIS avec un grade nucléaire élevé a plus de chances de se développer en carcinome du sein invasif.<ref name=":9">https:// | |||
{| class="wikitable" | {| class="wikitable" | ||
|+Grades nucléaires du CCIS | |+Grades nucléaires du CCIS | ||
| Ligne 93 : | Ligne 149 : | ||
!Caractéristiques | !Caractéristiques | ||
|- | |- | ||
!Faible | |||
|Petites cellules de taille et forme uniformes | | | ||
Nucléoles discrets | * Petites cellules de taille et forme uniformes | ||
* {{Signe paraclinique|nom=Nucléoles discrets}} | |||
|- | |- | ||
!Intermédiaire | |||
|Pris en compte lorsque les caractéristiques ne remplissent pas les critères d'un CCIS de grade nucléaire faible ou élevé | | | ||
Changements légers à modérés dans la taille et la forme du noyau | * Pris en compte lorsque les caractéristiques ne remplissent pas les critères d'un CCIS de grade nucléaire faible ou élevé | ||
* Changements légers à modérés dans la taille et la forme du noyau | |||
Quantité variable de mitose/nucléoles proéminents | * Quantité variable de mitose/nucléoles proéminents | ||
|- | |- | ||
| | !Élevé | ||
|Grandes cellules avec noyaux plémorphes | | | ||
Nucléoles proéminents | * {{Signe paraclinique|nom=Grandes cellules|affichage=Grandes cellules}} avec {{Signe paraclinique|nom=noyaux plémorphes|affichage=noyaux plémorphes}} | ||
* {{Signe paraclinique|nom=Nucléoles proéminents}} | |||
Mitoses fréquentes | * {{Signe paraclinique|nom=Mitoses fréquentes}} | ||
|} | |} | ||
==Diagnostic== | ==Diagnostic== | ||
Le diagnostic de CCIS nécessite une biopsie tissulaire. | Le diagnostic de CCIS nécessite une biopsie tissulaire. | ||
| Ligne 122 : | Ligne 172 : | ||
==Diagnostic différentiel== | ==Diagnostic différentiel== | ||
Le diagnostic différentiel comprend | Le diagnostic différentiel comprend<ref>{{Citation d'un lien web|titre=Breast Cancer Differential Diagnoses|url=https://emedicine.medscape.com/article/1947145-differential|site=emedicine.medscape.com|consulté le=2022-04-26|langue=|date=}}</ref> : | ||
*un {{Diagnostic différentiel|nom=cancer du sein invasif}}<ref group="note">Il est important de savoir que si une patiente a un CCIS, il existe un risque réel que la patiente soit déjà atteinte d'un cancer du sein invasif. La perturbation de la couche de membrane basale changerait le diagnostic de CCIS en cancer du sein invasif. Le CCIS est considéré comme un précurseur du cancer du sein invasif</ref><ref name=":1">{{Citation d'un article|prénom1=Maartje|nom1=van Seijen|prénom2=Esther H.|nom2=Lips|prénom3=Alastair M.|nom3=Thompson|prénom4=Serena|nom4=Nik-Zainal|titre=Ductal carcinoma in situ: to treat or not to treat, that is the question|périodique=British Journal of Cancer|volume=121|numéro=4|date=2019-08|issn=1532-1827|pmid=31285590|pmcid=6697179|doi=10.1038/s41416-019-0478-6|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/31285590/|consulté le=2022-05-08|pages=285–292}}</ref>, dont un {{Diagnostic différentiel|nom=lymphome du sein}} (rare) | |||
*une {{Diagnostic différentiel|nom=métastase mammaire}} (e.g. {{Diagnostic différentiel|nom=cancer neuroendocrinien}} ou {{Diagnostic différentiel|nom=leucémie myéloide aigue extramédullaire}}) | |||
* | *une {{Diagnostic différentiel|nom=lésion bénigne du sein}} ({{Diagnostic différentiel|nom=kyste mammaire}} ou {{Diagnostic différentiel|nom=fibroadénome du sein}}) | ||
* un épaississement de la peau secondaire à un {{Diagnostic différentiel|nom=carcinome inflammatoire}} ou une {{Diagnostic différentiel|nom=mastite péricanalaire}} | |||
Il est important de savoir que si une patiente a un | *la {{Diagnostic différentiel|nom=nécrose graisseuse traumatique}} | ||
*une {{Diagnostic différentiel|nom=mastite radique}} ou une {{Diagnostic différentiel|nom=cicatrice de radiothérapie}} | |||
* un {{Diagnostic différentiel|nom=papillome intracanalaire}} | |||
* une {{Diagnostic différentiel|nom=ectasie canalaire}} | |||
* une {{Diagnostic différentiel|nom=fibrose kystique mammaire}} | |||
* une {{Diagnostic différentiel|nom=adénose sclérosante}} | |||
* des {{Diagnostic différentiel|nom=microcalcifications bénignes}}. | |||
==Traitement== | ==Traitement== | ||
Le traitement du CCIS est multimodal et implique une combinaison de chirurgie, de radiothérapie et d'hormonothérapie personnalisée en fonction du diagnostic et des préférences spécifiques de la patiente.<ref name=":13" /> | |||
Le traitement du | |||
Les traitements suggérés sont les suivants : | Les traitements suggérés sont les suivants : | ||
*{{Traitement|nom=Chirurgie mammaire conservatrice}} | *la {{Traitement|nom=Chirurgie mammaire conservatrice|affichage=chirurgie mammaire conservatrice}} (mastectomie partielle) | ||
*{{Traitement|nom=Mastectomie}} | *la {{Traitement|nom=Mastectomie|affichage=mastectomie}} (totale) | ||
*{{Traitement|nom=Radiothérapie}} | *la {{Traitement|nom=Radiothérapie|affichage=radiothérapie}} | ||
* | *l'{{Traitement|nom=hormonothérapie}}. | ||
Les | Les options de traitement chirurgical du CCIS comprennent généralement une chirurgie mammaire conservatrice suivie d'une radiothérapie ou d'une simple mastectomie, avec traitement médical adjuvant. Avec l'une ou l'autre option de traitement, il est important de souligner qu'il existe une survie à long terme équivalente. | ||
La détermination est fondée sur les antécédents et les résultats de l'examen physique. L'esthétique et la taille de la lésion doivent être prises en considération ainsi que la préférence de la patiente. Une maladie multifocale et multicentrique et une lésion de grande taille peuvent faire de la chirurgie de conservation du sein une option moins esthétique que la mastectomie. | |||
Toute patiente identifiée comme présentant un risque élevé de cancer du sein héréditaire après avoir pris des antécédents familiaux détaillés de cancer devrait se faire proposer une {{Traitement|nom=consultation en génétique|affichage=consultation en génétique}}.<ref name=":03">{{Citation d'un ouvrage|prénom1=Sandra|nom1=Tomlinson-Hansen|prénom2=Myra|nom2=Khan|prénom3=Sebastiano|nom3=Cassaro|titre=StatPearls|éditeur=StatPearls Publishing|date=2022|pmid=33620843|lire en ligne=http://www.ncbi.nlm.nih.gov/books/NBK567766/|consulté le=2022-04-29}}</ref> | |||
=== Traitement chirurgical === | |||
{| class="wikitable" | |||
|+Traitements chirurgicaux du CCIS | |||
!Traitement | |||
!Explications | |||
!Contre-indications | |||
!Complications | |||
|- | |||
!Chirurgie mammaire conservatrice (conservation du sein) | |||
| | |||
* Par définition, le CCIS est non invasif et l'atteinte des ganglions lymphatiques axillaires est rare ; ainsi, la biopsie du ganglion sentinelle (GS) n'est pas indiquée pendant la chirurgie mammaire conservatrice.<ref name=":0" /><ref name=":13" /> | |||
* Étapes chirurgicales | |||
*# Localisation pré-chirurgicale de la lésion (majorité des lésions sont non palpables et uniquement visibles à l'imagerie). 2 méthodes (résultats comparables) : localisation par harpon immédiatement avant l'intervention ou bille radioactive sans fil dans les jours précédant la chirurgie. Les résultats sont comparables. | |||
*# Planification chirurgicale : imagerie préopératoire pour planifier la profondeur et l'emplacement de la masse. Tenir compte de la sécurité, de l'efficacité et de l'esthétique.<ref name=":0" /><ref name=":13" /> | |||
*# Chirurgie : La lésion doit être excisée sans pénétrer dans l'échantillon ni l'endommager avec un bistouri électrique excessif ou toute autre force excessive. Marge négative de 2 mm sur la pathologie finale. | |||
*# Imagerie radiographique peropératoire effectuée sur l'échantillon pour confirmer un fil, un microclip, un grain et une lésion intacts (si cette dernière est visible sur la radiographie). | |||
*# Après confirmation radiologique d'une biopsie satisfaisante, la zone de résection tissulaire doit être inspectée et palpée pour s'assurer qu'aucune autre zone de tissu préoccupant ne justifie une résection. | |||
*# Les clips doivent être placés pour marquer les limites du site de la tumorectomie pour la planification de la radiothérapie. | |||
| | |||
* Si impossibilité de suivre les traitements ultérieurs par radiothérapie post-chirurgicale (voir ci-bas) | |||
Les complications | * Si prédisposition génétique à développer un cancer du sein : considérer davantage la mastectomie.<ref name=":13" /> | ||
| rowspan="2" |Les complications sont sensiblement les mêmes pour les deux techniques chirurgicales : | |||
* des marges positives<ref group="note">Des marges positives après chirurgie de conservation mammaire varient de 20 à 70 % (ce qui nécessitera une réexcision)</ref> | |||
* une cellulite | |||
* un hématome | |||
* un sérome | |||
* une déhiscence de plaie | |||
* de la douleur | |||
* un lymphoedème | |||
* un pneumothorax (lors de la mise en place du fil) | |||
* une nécrose post-opératoire du lambeau (lambeaux cutanés trop fins) | |||
* un mauvais résultat esthétique. | |||
|- | |||
!Mastectomie totale | |||
| | |||
* La mastectomie est curative chez 98 % des patientes atteintes de CCIS, quelle que soit la taille ou le grade de la tumeur.<ref name=":14">{{Citation d'un article|prénom1=Laura A.|nom1=Lee|prénom2=Melvin J.|nom2=Silverstein|prénom3=Cathie T.|nom3=Chung|prénom4=Heather|nom4=Macdonald|titre=Breast cancer-specific mortality after invasive local recurrence in patients with ductal carcinoma-in-situ of the breast|périodique=American Journal of Surgery|volume=192|numéro=4|date=2006-10|issn=0002-9610|pmid=16978940|doi=10.1016/j.amjsurg.2006.06.005|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/16978940/|consulté le=2022-05-08|pages=416–419}}</ref> | |||
* Pas de nécessité pré-opératoire de localiser la lésion. | |||
* Biopsie du ganglion sentinelle recommandée en même temps que la mastectomie en raison de l'impossibilité d'effectuer une biopsie du ganglion sentinelle après la mastectomie si la lésion plus avancée qu'initialement prévue sur la pathologie finale en cancer du sein invasif. | |||
* Étapes | |||
# Planification chirurgicale : La planification chirurgicale doit tenir compte des plans post-mastectomie pour la reconstruction et l'esthétique. Une mastectomie totale avec reconstruction immédiate est possible. On conservera alors le complexe mammelono-aréoaire. Ceci guidera le choix de l'incision et la mise en place possible d'extenseurs tissulaire. | |||
# Cartographie du ganglion sentinelle avec un radio-isotope et/ou un colorant bleu (bleu de méthylène, lymphazurin, etc.)<ref name=":13" /> | |||
# Dissection de la mastectomie simple doit être effectuée en haut de la clavicule, en dedans du sternum, en haut de la gaine antérieure du muscle grand droit, latéralement au latissimus dorsi et en arrière du muscle pectoral, en veillant à inclure le fascia pectoral dans l'échantillon.<ref name=":13" /> | |||
# Biopsie du ganglion sentinelle homolatérale, idéalement en utilisant la même incision. | |||
# Hémostase doit être obtenue | |||
# Un drain ou deux doivent être placés dans le site de mastectomie. En post-opératoire, les drains sont retirés une fois que le débit de drain est inférieur à environ 30 ml sur une période de 24 heures.<ref name=":13" /> | |||
| | |||
|} | |||
Il n'y a pas de place à un traitement néoadjuvant pour le carcinome canalaire in situ. | |||
Après avoir procédé à une chirurgie visant à enlever les tissus pré-cancéreux affectés par le CCIS, des traitements médicaux sont proposés. Pour les patientes non candidates à un traitement adjuvant par radiothérapie ou hormonothérapie, la chirurgie constitue souvent la seule ligne de traitement avec suivi post-opératoire. | |||
=== Traitement médical === | |||
{| class="wikitable" | |||
|+Traitements médicaux du CCIS | |||
!Traitement | |||
!Explications | |||
!Complications/ Effets secondaires | |||
!Contre-indications | |||
|- | |||
!Radiothérapie | |||
| | |||
* En post-opératoire, la patiente devra subir une radiothérapie (sauf contre-indication). | |||
* Avant de commencer la radiothérapie: | |||
** Confirmation pathologique et radiologique des marges négatives de la chirurgie OU | |||
** Réopération pour une excision tissulaire supplémentaire | |||
* Nécessite des marges négatives de 2 mm idéalement, mais des marges négatives sont suffisantes <ref name=":20">{{Citation d'un article|prénom1=Henry M.|nom1=Kuerer|prénom2=Benjamin D.|nom2=Smith|prénom3=Mariana|nom3=Chavez-MacGregor|prénom4=Constance|nom4=Albarracin|titre=DCIS Margins and Breast Conservation: MD Anderson Cancer Center Multidisciplinary Practice Guidelines and Outcomes|périodique=Journal of Cancer|volume=8|numéro=14|date=2017|issn=1837-9664|pmid=28928852|pmcid=5604195|doi=10.7150/jca.20871|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/28928852/|consulté le=2022-05-08|pages=2653–2662}}</ref><ref name=":21">{{Citation d'un article|prénom1=Monica|nom1=Morrow|prénom2=Kimberly J.|nom2=Van Zee|prénom3=Lawrence J.|nom3=Solin|prénom4=Nehmat|nom4=Houssami|titre=Society of Surgical Oncology-American Society for Radiation Oncology-American Society of Clinical Oncology Consensus Guideline on Margins for Breast-Conserving Surgery With Whole-Breast Irradiation in Ductal Carcinoma in Situ|périodique=Practical Radiation Oncology|volume=6|numéro=5|date=2016-09|issn=1879-8519|pmid=27538810|pmcid=5070537|doi=10.1016/j.prro.2016.06.011|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/27538810/|consulté le=2022-05-08|pages=287–295}}</ref> | |||
* Après avoir obtenu des marges négatives dans la mastectomie partielle, la radiothérapie suivra pour éliminer toute maladie résiduelle. | |||
* Réduction de 50 à 60 % des récidives locales avec l'excision chirurgicale et la radiothérapie par rapport à l'excision chirurgicale seule. | |||
* Dose totale de 50 à 60 Gy après une thérapie mammaire conservatrice. Radiothérapie 5 jours par semaine avec des fractions de 2 Gy de radiation pendant un total de 5 semaines après la mastectomie partielle. Désormais, un protocole de 5 Gy die x 5 jours est souvent suffisant. L'objectif est de réduire le risque de récidive locorégionale de la chirurgie suivante en éradiquant toute maladie locorégionale persistante. | |||
| | |||
* Radiodermites et autres modifications de la peau et des tissus (atrophie, décoloration, etc.) | |||
* Fatigue | |||
* Toux | |||
* Essoufflement | |||
* Fractures des côtes | |||
* Plexopathie brachiale | |||
* Angiosarcome (très rare)<ref name=":0" /> | |||
| | |||
* Grossesse | |||
* Antécédents de radiothérapie | |||
* Stimulateur cardiaque | |||
* Antécédent de maladie pulmonaire avancée réduisant considérablement la capacité de diffusion | |||
* Troubles du tissu conjonctif sévère (sclérodermie, lupus érythémateux disséminé, etc.) avec une vasculite importante.<ref name=":13" /> | |||
|- | |||
!Modulateurs sélectifs des récepteurs aux œstrogènes (Tamoxifène et Raloxifène)<ref group="note">Modulateur sélectif des récepteurs à oestrogènes avec un mode d'action complexe : antagoniste au niveau du tissu du sein et agoniste partiel au niveau de l'endomètre et des os</ref><ref name=":13" /> | |||
| | |||
* Utilisés en chimioprévention post-op; réduit l'incidence du cancer du sein chez les patientes pré et post ménopausées. | |||
* Réservés aux patientes atteintes de CCIS ER-positif ou PR-positif (CCIS exprimant des récepteurs d'œstrogènes et/ou de progestérone) comme traitement adjuvant de chirurgie et radiothérapie. | |||
* 5 ans de thérapie endocrinienne réduisent le risque de maladie à la fois ipsilatérale et controlatérale. | |||
* Dose Tamoxifène pour CCIS: 20mg PO die x 5 ans | |||
* Dose Raloxifène pour CCIS: 60mg PO die x 5 ans (femmes post-ménopausées à haut risque de cancer du sein invasif) <ref>{{Citation d'un lien web|titre=Soltamox (tamoxifen) dosing, indications, interactions, adverse effects, and more|url=https://reference.medscape.com/drug/soltamox-tamoxifen-342183|site=reference.medscape.com|consulté le=2022-05-25}}</ref> | |||
| | |||
* Cancer de l'endomètre (moins de risque avec le Raloxifène) | |||
* Événement thromboembolique (TVP, embolie pulmonaire, AVC) | |||
* Cataractes | |||
* Troubles vasomoteurs | |||
| | |||
* Mastectomie bilatérale | |||
* Grossesse/ allaitement | |||
|- | |||
!Inhibiteurs de l'aromatase<ref name=":13" /> | |||
| | |||
* Plus efficaces que le tamoxifène pour réduire l'incidence des cancers du sein controlatéral chez les patientes ménopausées (1e ligne de tx adjuvant pour cette population) | |||
* Surtout utilisés comme traitement adjuvant pour le cancer du sein invasif | |||
* 3 générations d'efficacité équivalente : | |||
** Inhibiteurs non-stéroidiens réversibles (anastrozole et letrozole) | |||
** Inihbiteurs irreversibles stéroidiens (exémestane) | |||
| | |||
* Arthrite | |||
* Bouffées de chaleur | |||
* Diminution de la densité osseuse (risque accru d'ostéoporose et fractures) | |||
| | |||
* Pré-ménopause ou péri-ménopause | |||
* Mastectomie bilatérale | |||
|} | |||
==Suivi== | ==Suivi== | ||
Six mois après la fin de la radiothérapie, une mammographie de surveillance doit être initiée avec une imagerie annuelle. Des examens bilatéraux semestriels des seins et des ganglions lymphatiques sont indiqués pendant deux ans, puis annuellement par la suite.<ref name=":21" /><ref name=":0" />Après avoir terminé la radiothérapie, la patiente peut envisager de consulter un chirurgien plasticien ou oncologue du sein pour des options de reconstruction oncoplastique.<ref name=":0" /> | |||
Dans le cas de la mastectomie, après l'opération, une fois que la patiente a guéri de la mastectomie et que les résultats de la pathologie ont été examinés, la patiente peut planifier une chirurgie de reconstruction mammaire.<ref name=":0" /> | |||
Bien que l'imagerie du sein retiré ne soit pas nécessaire pour la surveillance, le sein controlatéral doit être examiné via des mammographies annuelles. Des examens bilatéraux semestriels des seins et des ganglions lymphatiques sont indiqués pendant deux ans, puis annuellement par la suite.<ref name=":0" /> | |||
==Complications== | ==Complications== | ||
La complication principale du CCIS est la progression vers un {{Complication|nom=cancer du sein invasif|taux=36-100}} à un temps de progression de 0.2 à 2.5 ans.<ref name=":5">{{Citation d'un article|prénom1=Sarocha|nom1=Chootipongchaivat|prénom2=Nicolien T.|nom2=van Ravesteyn|prénom3=Xiaoxue|nom3=Li|prénom4=Hui|nom4=Huang|titre=Modeling the natural history of ductal carcinoma in situ based on population data|périodique=Breast cancer research: BCR|volume=22|numéro=1|date=2020-05-27|issn=1465-542X|pmid=32460821|pmcid=7251719|doi=10.1186/s13058-020-01287-6|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/32460821/|consulté le=2022-05-08|pages=53}}</ref><ref name=":0" /> | |||
La complication principale du CCIS est la progression vers un cancer du sein invasif | |||
==Évolution== | ==Évolution== | ||
Il y a toujours une augmentation de la mortalité par cancer du sein avec un diagnostic de CCIS. Le taux de mortalité global par cancer du sein 20 ans après le diagnostic de CCIS est de 3,3%, un taux triple de celui de la population générale<ref name=":15">{{Citation d'un article|langue=en|prénom1=Vasily|nom1=Giannakeas|prénom2=Victoria|nom2=Sopik|prénom3=Steven A.|nom3=Narod|titre=Association of a Diagnosis of Ductal Carcinoma In Situ With Death From Breast Cancer|périodique=JAMA Network Open|volume=3|numéro=9|date=2020-09-16|issn=2574-3805|pmid=32936299|pmcid=PMC7495235|doi=10.1001/jamanetworkopen.2020.17124|lire en ligne=https://jamanetwork.com/journals/jamanetworkopen/fullarticle/2770653|consulté le=2022-05-25|pages=e2017124}}</ref>. | |||
Cela dit, étant donné la nature non invasive du CCIS, les métastases et/ou le décès chez les femmes atteintes et traitées adéquatemment sont rares.<ref name=":26">{{Citation d'un article|prénom1=Robert E.|nom1=Roses|prénom2=Banu K.|nom2=Arun|prénom3=Sara A.|nom3=Lari|prénom4=Elizabeth A.|nom4=Mittendorf|titre=Ductal carcinoma-in-situ of the breast with subsequent distant metastasis and death|périodique=Annals of Surgical Oncology|volume=18|numéro=10|date=2011-10|issn=1534-4681|pmid=21476105|doi=10.1245/s10434-011-1707-2|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/21476105/|consulté le=2022-05-08|pages=2873–2878}}</ref> Il existe un excellent pronostic avec une espérance de vie normale pour la grande majorité des patientes qui suivent un traitement. Si non traité, cependant, le CCIS se transforme généralement en cancer invasif qui peut être mortel.<ref name=":0" /> | |||
Il existe six facteurs liés à un risque plus élevé de récidive du cancer du sein invasif<ref name=":28">{{Citation d'un article|prénom1=Lindy L.|nom1=Visser|prénom2=Emma J.|nom2=Groen|prénom3=Flora E.|nom3=van Leeuwen|prénom4=Esther H.|nom4=Lips|titre=Predictors of an Invasive Breast Cancer Recurrence after DCIS: A Systematic Review and Meta-analyses|périodique=Cancer Epidemiology, Biomarkers & Prevention: A Publication of the American Association for Cancer Research, Cosponsored by the American Society of Preventive Oncology|volume=28|numéro=5|date=2019-05|issn=1538-7755|pmid=31023696|doi=10.1158/1055-9965.EPI-18-0976|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/31023696/|consulté le=2022-05-08|pages=835–845}}</ref>: | |||
* | * la préménopause | ||
* | * des marges positives | ||
* CCIS de haut grade | * un CCIS de haut grade | ||
* | * des niveaux élevés de protéine p16 | ||
* | * une origine afro-américaine. | ||
La prévention des récidives invasives du sein avec la radiothérapie ou la mastectomie ne réduisent pas la mortalité spécifique au cancer du sein. <ref name=":15" /><ref name=":0" /> | |||
==Prévention== | ==Prévention== | ||
Comprendre que l'augmentation des niveaux d'œstrogènes exogènes augmente le risque de cancer du sein est important | Comprendre que l'augmentation des niveaux d'œstrogènes exogènes augmente le risque de cancer du sein est important pour l'éducation des patientes. Les modifications du mode de vie et du comportement incluent<ref name=":0" />: | ||
* l'arrêt de la consommation d'alcool | |||
* l'arrêt de l'utilisation des hormones postménopausiques. | |||
== Notes == | |||
<references group="note" /> | |||
==Références== | ==Références== | ||
{{Article importé d'une source | {{Article importé d'une source | ||
| Ligne 254 : | Ligne 356 : | ||
| source = StatPearls | | source = StatPearls | ||
| version_outil_d'importation = 0.2a | | version_outil_d'importation = 0.2a | ||
| révisé = | | révisé = 1 | ||
| révision = 2021/07/25 | | révision = 2021/07/25 | ||
| pmid = 33620843 | | pmid = 33620843 | ||
| nom = Breast Ductal Carcinoma in Situ | | nom = Breast Ductal Carcinoma in Situ | ||
}} | | url = | ||
<references /> | }}{{Article de l'application de chirurgie générale | ||
| date = 2022-03-05 | |||
}}<references /> | |||
Dernière version du 19 avril 2024 à 16:47
| Maladie | |||
 Cancer canalaire in situ | |||
| Caractéristiques | |||
|---|---|---|---|
| Signes | Masse mammaire, Écoulement mammaire , Maladie de Paget mammaire, Examen mammaire normal | ||
| Symptômes |
Masse mammaire, Asymptomatique , Écoulement mamelonnaire, Antécédents d'imagerie mammaire antérieure, Antécédents de biopsies mammaires antérieures | ||
| Diagnostic différentiel |
Ectasie canalaire, Lymphome du sein, Fibroadénome du sein, Papillome intracanalaire, Kyste mammaire, Mastite péricanalaire, Mastite radique, Cancer du sein invasif, Lésion bénigne du sein, Cancer neuroendocrinien, ... [+] | ||
| Informations | |||
| Terme anglais | Ductal Carcinoma in Situ | ||
| Autres noms | Carcinome intracanalaire | ||
| Wikidata ID | Q337585 | ||
| SNOMED CT ID | 1162814007 | ||
| Spécialités | Chirurgie générale, Radiologie, Oncologie, Radio-oncologie | ||
| |||
Le carcinome canalaire in situ (CCIS), également appelé carcinome intracanalaire, est un cancer du sein non invasif caractérisé par une prolifération néoplasique de cellules épithéliales anormales confinées dans la membrane basale du système canalo-lobulaire mammaire. Le CCIS se présente par une atypie cytologique subtile qui ne progresse pas nécessairement vers un cancer du sein invasif.[1][2]
Le CCIS est classé comme Tis et correspond à un cancer du sein de stade 0.
Épidémiologie
Le cancer du sein est le cancer le plus fréquent chez les femmes au Québec. Chez les femmes âgées de 50 à 64 ans, le risque de CCIS peut atteindre 88 pour 100 000 femmes.[3] Aujourd'hui, 20 % à 25 % des cancers du sein diagnostiqués aux États-Unis sont des CCIS. Cela a augmenté parallèlement à l'utilisation de la mammographie de dépistage, car un pourcentage important de CCIS est identifié pour la première fois lors de la mammographie de dépistage. À l'ère de la mammographie de pré-dépistage, moins de 5 % des cancers du sein nouvellement diagnostiqués étaient des CCIS.[2]
Selon l'Institut national de santé publique du Québec, le taux de détection des CCIS entre 2002 et 2015 variait entre 1,0 et 1,5 pour 1 000 femmes participant au Programme québécois de dépistage du cancer du sein[4]. Les CCIS représentaient environ 20 % de tous les cancers du sein détectés[4].
Étiologies
L'évolution du tissu mammaire normal en CCIS est inconnue.
Les hormones jouent un rôle important dans le développement du cancer. Le temps d'exposition aux oestrogènes est lié au développement du CCIS. Il a aussi été prouvé que les oestrogènes et ses métabolites ainsi que d'autres hormones stéroïdiennes comme la progestérone ont tous un effet sur le développement et l'évolution de certains cancer du sein. Ces cancers ont une meilleure réponse au traitement.[5]
Physiopathologie
Le CCIS est une prolifération clonale de cellules épithéliales dans l'unité canalo-lobulaire du sein confinée à la membrane basale des cellules myoépithéliales. Ce confinement à la couche de cellules myoépithéliales la démarque du carcinome mammaire invasif.
On peut voir le CCIS comme faisant partie d'un spectrum de modification des cellules canalaires débutant par des modifications bénignes qui sont le produit du développement du sein et de l'involution. Certaines sont prolifératives alors que d'autres non. Ces processus peuvent se transformer à leur tour en atypies ou en processus malin[5].
De manière générale, une hyperplasie canalaire atypique est la première étape vers le CCIS. Celle-ci apparaitra comme une lésion de CCIS de bas grade avec des présentations histologiques similaires au CCIS mesurant entre 2 et 3 mm. Si la lésion atteint plus de 3 mm, elle sera considérée comme un CCIS[5].
Présentation clinique
Facteurs de risque
Les facteurs de risque du CCIS sont les mêmes que pour le cancer du sein invasif [2][6][7][8]:
- l'âge avancé
- la prédisposition génétique (BRCA1 et BRCA2)
- l'exposition aux oestrogènes exogènes (dont les traitements hormonaux substitutifs chez les femmes ménopausées et l'utilisation de contraceptifs oraux combinés)
- l'exposition aux oestrogènes endogènes[note 1]
- la consommation d'alcool
- les antécédents familiaux de cancer du sein des parents du premier degré
- les antécédents familiaux de cancer
- la maladie de Paget mammaire
- l'hyperplasie canalaire atypique.
Questionnaire
Cette maladie est généralement asymptomatique [Pr: 90 %] : 90% de tous les cas de CCIS sont détectés à partir de mammographies de dépistage[9] . De nombreuses femmes se présentent pour un examen des seins après qu'une anomalie ait été décelée lors des mammographies de dépistage.
Si la lésion est péri-aréolaire, elle peut donner un écoulement mamelonnaire. Il peut y avoir un effet de masse perceptible chez certaines formes de CCIS extensifs.
On questionnera aussi la patiente pour ses antécédents d'imagerie ou de biopsies mammaires antérieures.
Examen clinique
L'examen clinique regroupera les éléments suivants :
- à l'examen mammaire, on peut retrouver les éléments suivants[2] :
- le plus souvent, l'examen mammaire est normal
- des changements cutanés suggestifs d'une maladie de Paget mammaire
- un écoulement mammaire unicanalaire (eau de roche ou sanguinolent)
- une masse mammaire(rare).
- l'examen des aires ganglionnaires
- il n'y a pas d'adénopathie dans le CCIS ; toute adénopathie est en faveur d'un cancer invasif.
Examens paracliniques
| Modalité | Explications |
|---|---|
| Mammographie de dépistage[10] |
|
| Mammographie diagnostique |
|
| Tomosynthèse mammaire |
|
| IRM mammaire |
|
| Biopsie au trocart |
|
Histopathologie
Les canaux mammaires normaux se terminent par une unité lobulaire terminale (TDLU). Le conduit se termine par des lobules constitués de petites structures glandulaires appelées acini. Il existe une bicouche de cellules tapissant le système canalo-lobulaire constitué de cellules épithéliales luminales internes et de cellules myoépithéliales luminales externes. La majorité des lésions mammaires (bénignes ou malignes) se développent dans le TDLU.[2]
Des immunocolorations peuvent être effectuées pour montrer la rétention des cellules myoépithéliales, telles que la cytokératine 5/6, la myosine des muscles lisses et la p63. Histologiquement, le CCIS est classé selon les caractéristiques de l'architecture, le grade nucléaire (grade de Nottingham) et/ou la présence de nécrose.[2]
| Caractéristiques | Grade | |
|---|---|---|
| comédonécrose | Les cellules malignes au centre du canal subissent une nécrose, parfois avec des calcifications[note 4][12]. | Non défini |
| motif cribiforme | Les cellules tumorales remplissent le canal et forment des pseudo-lumières qui apparaissent comme des espaces perforés. | Bas |
| motif micropapillaire | Les cellules en prolifération forment des touffes en forme de massue et se projettent dans la lumière du canal sans noyau fibrovasculaire | Bas |
| motif papillaire | Les cellules prolifèrent autour des noyaux fibrovasculaires | Haut |
| masse solide | Les cellules remplissent et dilatent le conduit | Haut |
Les CCIS avec des caractéristiques solides ou comédoniennes sont considérés comme des lésions de haut grade et les CCIS de haut grade ont plus tendance à se développer en carcinome invasif. Il est courant de voir plusieurs modèles architecturaux dans le CCIS. [13][2]
Le CCIS est classé en trois grades nucléaires désignés comme faible, intermédiaire ou élevé. Le CCIS avec un grade nucléaire élevé a plus de chances de se développer en carcinome du sein invasif.[14][2]
| Grades | Caractéristiques |
|---|---|
| Faible |
|
| Intermédiaire |
|
| Élevé |
Diagnostic
Le diagnostic de CCIS nécessite une biopsie tissulaire.
Bien que groupé, le CCIS est, en réalité, un groupe hétérogène de lésions qui varie dans la présentation clinique, la génétique, les biomarqueurs, les caractéristiques morphologiques, ainsi que le potentiel clinique de progression vers un cancer du sein invasif. Les taux de diagnostic ont augmenté avec l'utilisation de la mammographie de dépistage qui détecte les microcalcifications précliniques.
Diagnostic différentiel
Le diagnostic différentiel comprend[15] :
- un cancer du sein invasif[note 5][16], dont un lymphome du sein (rare)
- une métastase mammaire (e.g. cancer neuroendocrinien ou leucémie myéloide aigue extramédullaire)
- une lésion bénigne du sein (kyste mammaire ou fibroadénome du sein)
- un épaississement de la peau secondaire à un carcinome inflammatoire ou une mastite péricanalaire
- la nécrose graisseuse traumatique
- une mastite radique ou une cicatrice de radiothérapie
- un papillome intracanalaire
- une ectasie canalaire
- une fibrose kystique mammaire
- une adénose sclérosante
- des microcalcifications bénignes.
Traitement
Le traitement du CCIS est multimodal et implique une combinaison de chirurgie, de radiothérapie et d'hormonothérapie personnalisée en fonction du diagnostic et des préférences spécifiques de la patiente.[5]
Les traitements suggérés sont les suivants :
- la chirurgie mammaire conservatrice (mastectomie partielle)
- la mastectomie (totale)
- la radiothérapie
- l'hormonothérapie.
Les options de traitement chirurgical du CCIS comprennent généralement une chirurgie mammaire conservatrice suivie d'une radiothérapie ou d'une simple mastectomie, avec traitement médical adjuvant. Avec l'une ou l'autre option de traitement, il est important de souligner qu'il existe une survie à long terme équivalente.
La détermination est fondée sur les antécédents et les résultats de l'examen physique. L'esthétique et la taille de la lésion doivent être prises en considération ainsi que la préférence de la patiente. Une maladie multifocale et multicentrique et une lésion de grande taille peuvent faire de la chirurgie de conservation du sein une option moins esthétique que la mastectomie.
Toute patiente identifiée comme présentant un risque élevé de cancer du sein héréditaire après avoir pris des antécédents familiaux détaillés de cancer devrait se faire proposer une consultation en génétique.[17]
Traitement chirurgical
| Traitement | Explications | Contre-indications | Complications |
|---|---|---|---|
| Chirurgie mammaire conservatrice (conservation du sein) |
|
|
Les complications sont sensiblement les mêmes pour les deux techniques chirurgicales :
|
| Mastectomie totale |
|
Il n'y a pas de place à un traitement néoadjuvant pour le carcinome canalaire in situ.
Après avoir procédé à une chirurgie visant à enlever les tissus pré-cancéreux affectés par le CCIS, des traitements médicaux sont proposés. Pour les patientes non candidates à un traitement adjuvant par radiothérapie ou hormonothérapie, la chirurgie constitue souvent la seule ligne de traitement avec suivi post-opératoire.
Traitement médical
| Traitement | Explications | Complications/ Effets secondaires | Contre-indications |
|---|---|---|---|
| Radiothérapie |
|
|
|
| Modulateurs sélectifs des récepteurs aux œstrogènes (Tamoxifène et Raloxifène)[note 7][5] |
|
|
|
| Inhibiteurs de l'aromatase[5] |
|
|
|
Suivi
Six mois après la fin de la radiothérapie, une mammographie de surveillance doit être initiée avec une imagerie annuelle. Des examens bilatéraux semestriels des seins et des ganglions lymphatiques sont indiqués pendant deux ans, puis annuellement par la suite.[20][2]Après avoir terminé la radiothérapie, la patiente peut envisager de consulter un chirurgien plasticien ou oncologue du sein pour des options de reconstruction oncoplastique.[2]
Dans le cas de la mastectomie, après l'opération, une fois que la patiente a guéri de la mastectomie et que les résultats de la pathologie ont été examinés, la patiente peut planifier une chirurgie de reconstruction mammaire.[2]
Bien que l'imagerie du sein retiré ne soit pas nécessaire pour la surveillance, le sein controlatéral doit être examiné via des mammographies annuelles. Des examens bilatéraux semestriels des seins et des ganglions lymphatiques sont indiqués pendant deux ans, puis annuellement par la suite.[2]
Complications
La complication principale du CCIS est la progression vers un cancer du sein invasif (36-100 %) à un temps de progression de 0.2 à 2.5 ans.[22][2]
Évolution
Il y a toujours une augmentation de la mortalité par cancer du sein avec un diagnostic de CCIS. Le taux de mortalité global par cancer du sein 20 ans après le diagnostic de CCIS est de 3,3%, un taux triple de celui de la population générale[23].
Cela dit, étant donné la nature non invasive du CCIS, les métastases et/ou le décès chez les femmes atteintes et traitées adéquatemment sont rares.[24] Il existe un excellent pronostic avec une espérance de vie normale pour la grande majorité des patientes qui suivent un traitement. Si non traité, cependant, le CCIS se transforme généralement en cancer invasif qui peut être mortel.[2]
Il existe six facteurs liés à un risque plus élevé de récidive du cancer du sein invasif[25]:
- la préménopause
- des marges positives
- un CCIS de haut grade
- des niveaux élevés de protéine p16
- une origine afro-américaine.
La prévention des récidives invasives du sein avec la radiothérapie ou la mastectomie ne réduisent pas la mortalité spécifique au cancer du sein. [23][2]
Prévention
Comprendre que l'augmentation des niveaux d'œstrogènes exogènes augmente le risque de cancer du sein est important pour l'éducation des patientes. Les modifications du mode de vie et du comportement incluent[2]:
- l'arrêt de la consommation d'alcool
- l'arrêt de l'utilisation des hormones postménopausiques.
Notes
- ↑ Approximé par l'âge à la ménarche, l'âge à la ménopause et l'âge du premier accouchement à terme, le nombre de grossesse
- ↑ Dispositif de compression placé directement sur une anomalie mammographique identifiée cachée par des tissus
- ↑ Techniques de grossissement (×1,5) souvent associées à la compression ponctuelle pour mieux visualiser les calcifications et les marges des masses.
- ↑ La comédonécrose est souvent décrite pour caractériser certains CCIS mais ne confère pas de grade ni d'architecture spécifique à la lésion. Il n'y a pas de consensus dans la littérature sur la quantité de nécrose centrale nécessaire pour qualifier une lésion de bas ou haut grade.
- ↑ Il est important de savoir que si une patiente a un CCIS, il existe un risque réel que la patiente soit déjà atteinte d'un cancer du sein invasif. La perturbation de la couche de membrane basale changerait le diagnostic de CCIS en cancer du sein invasif. Le CCIS est considéré comme un précurseur du cancer du sein invasif
- ↑ Des marges positives après chirurgie de conservation mammaire varient de 20 à 70 % (ce qui nécessitera une réexcision)
- ↑ Modulateur sélectif des récepteurs à oestrogènes avec un mode d'action complexe : antagoniste au niveau du tissu du sein et agoniste partiel au niveau de l'endomètre et des os
Références
- Cette page a été modifiée ou créée le 2021/12/22 à partir de Breast Ductal Carcinoma in Situ (StatPearls / Breast Ductal Carcinoma in Situ (2021/07/25)), écrite par les contributeurs de StatPearls et partagée sous la licence CC-BY 4.0 international (jusqu'au 2022-12-08). Le contenu original est disponible à https://www.ncbi.nlm.nih.gov/pubmed/33620843 (livre).
- Cet article a été créé en partie ou en totalité le 2022-03-05 à partir de Chirurgie (application), créée par Dre Hélène Milot, Dr Olivier Mailloux et collaborateurs et partagé sous la licence CC-BY-SA 4.0 international
- ↑ Puay Hoon Tan, Ian Ellis, Kimberly Allison et Edi Brogi, « The 2019 World Health Organization classification of tumours of the breast », Histopathology, vol. 77, no 2, , p. 181–185 (ISSN 1365-2559, PMID 32056259, DOI 10.1111/his.14091, lire en ligne)
- ↑ 2,00 2,01 2,02 2,03 2,04 2,05 2,06 2,07 2,08 2,09 2,10 2,11 2,12 2,13 2,14 2,15 2,16 2,17 2,18 2,19 et 2,20 Sandra Tomlinson-Hansen, Myra Khan et Sebastiano Cassaro, StatPearls, StatPearls Publishing, (PMID 33620843, lire en ligne)
- ↑ Karla Kerlikowske, « Epidemiology of ductal carcinoma in situ », Journal of the National Cancer Institute. Monographs, vol. 2010, no 41, , p. 139–141 (ISSN 1745-6614, PMID 20956818, Central PMCID 5161058, DOI 10.1093/jncimonographs/lgq027, lire en ligne)
- ↑ 4,0 et 4,1 « Portrait des carcinomes canalaires in situ dans le Programme québécois de dépistage du cancer du sein », sur INSPQ.qc.ca, (consulté le 25 avril 2022)
- ↑ 5,00 5,01 5,02 5,03 5,04 5,05 5,06 5,07 5,08 5,09 5,10 5,11 5,12 et 5,13 (en) Brunicardi F, & Andersen D.K., & Billiar T.R., & Dunn D.L., & Kao L.S., & Hunter J.G., & Matthews J.B., & Pollock R.E.(Eds.),Eds. F. Charles Brunicardi, et al., Schwartz's Principles of Surgery, United States, McGraw-Hill Education, , 2448 p. (ISBN 1259835359), p. Chapter 17
- ↑ Rebecca Siegel, Jiemin Ma, Zhaohui Zou et Ahmedin Jemal, « Cancer statistics, 2014 », CA: a cancer journal for clinicians, vol. 64, no 1, , p. 9–29 (ISSN 1542-4863, PMID 24399786, DOI 10.3322/caac.21208, lire en ligne)
- ↑ Rowan T. Chlebowski, Garnet L. Anderson, Margery Gass et Dorothy S. Lane, « Estrogen plus progestin and breast cancer incidence and mortality in postmenopausal women », JAMA, vol. 304, no 15, , p. 1684–1692 (ISSN 1538-3598, PMID 20959578, Central PMCID 5142300, DOI 10.1001/jama.2010.1500, lire en ligne)
- ↑ Michael Co, Andrea Lee et Ava Kwong, « Non-surgical treatment for ductal carcinoma in situ of the breasts - a prospective study on patient's perspective », Cancer Treatment and Research Communications, vol. 26, , p. 100241 (ISSN 2468-2942, PMID 33340904, DOI 10.1016/j.ctarc.2020.100241, lire en ligne)
- ↑ D. D. Dershaw, A. Abramson et D. W. Kinne, « Ductal carcinoma in situ: mammographic findings and clinical implications », Radiology, vol. 170, no 2, , p. 411–415 (ISSN 0033-8419, PMID 2536185, DOI 10.1148/radiology.170.2.2536185, lire en ligne)
- ↑ R. Holland, J. H. Hendriks, A. L. Vebeek et M. Mravunac, « Extent, distribution, and mammographic/histological correlations of breast ductal carcinoma in situ », Lancet (London, England), vol. 335, no 8688, , p. 519–522 (ISSN 0140-6736, PMID 1968538, DOI 10.1016/0140-6736(90)90747-s, lire en ligne)
- ↑ Nehmat Houssami, Stefano Ciatto, Ian Ellis et Daniela Ambrogetti, « Underestimation of malignancy of breast core-needle biopsy: concepts and precise overall and category-specific estimates », Cancer, vol. 109, no 3, , p. 487–495 (ISSN 0008-543X, PMID 17186530, DOI 10.1002/cncr.22435, lire en ligne)
- ↑ (en) Sarah E. Pinder, « Ductal carcinoma in situ (DCIS): pathological features, differential diagnosis, prognostic factors and specimen evaluation », Modern Pathology, vol. 23, no 2, , S8–S13 (ISSN 1530-0285, DOI 10.1038/modpathol.2010.40, lire en ligne)
- ↑ Claudia Stanciu-Pop, Marie-Cécile Nollevaux, Martine Berlière et Francois P. Duhoux, « Morphological intratumor heterogeneity in ductal carcinoma in situ of the breast », Virchows Archiv: An International Journal of Pathology, vol. 479, no 1, , p. 33–43 (ISSN 1432-2307, PMID 33502600, DOI 10.1007/s00428-021-03040-6, lire en ligne)
- ↑ Bruno Cutuli, Claire Lemanski, Brigitte De Lafontan et Marie-Pierre Chauvet, « Ductal Carcinoma in Situ: A French National Survey. Analysis of 2125 Patients », Clinical Breast Cancer, vol. 20, no 2, , e164–e172 (ISSN 1938-0666, PMID 31780381, DOI 10.1016/j.clbc.2019.08.002, lire en ligne)
- ↑ « Breast Cancer Differential Diagnoses », sur emedicine.medscape.com (consulté le 26 avril 2022)
- ↑ Maartje van Seijen, Esther H. Lips, Alastair M. Thompson et Serena Nik-Zainal, « Ductal carcinoma in situ: to treat or not to treat, that is the question », British Journal of Cancer, vol. 121, no 4, , p. 285–292 (ISSN 1532-1827, PMID 31285590, Central PMCID 6697179, DOI 10.1038/s41416-019-0478-6, lire en ligne)
- ↑ Sandra Tomlinson-Hansen, Myra Khan et Sebastiano Cassaro, StatPearls, StatPearls Publishing, (PMID 33620843, lire en ligne)
- ↑ Laura A. Lee, Melvin J. Silverstein, Cathie T. Chung et Heather Macdonald, « Breast cancer-specific mortality after invasive local recurrence in patients with ductal carcinoma-in-situ of the breast », American Journal of Surgery, vol. 192, no 4, , p. 416–419 (ISSN 0002-9610, PMID 16978940, DOI 10.1016/j.amjsurg.2006.06.005, lire en ligne)
- ↑ Henry M. Kuerer, Benjamin D. Smith, Mariana Chavez-MacGregor et Constance Albarracin, « DCIS Margins and Breast Conservation: MD Anderson Cancer Center Multidisciplinary Practice Guidelines and Outcomes », Journal of Cancer, vol. 8, no 14, , p. 2653–2662 (ISSN 1837-9664, PMID 28928852, Central PMCID 5604195, DOI 10.7150/jca.20871, lire en ligne)
- ↑ 20,0 et 20,1 Monica Morrow, Kimberly J. Van Zee, Lawrence J. Solin et Nehmat Houssami, « Society of Surgical Oncology-American Society for Radiation Oncology-American Society of Clinical Oncology Consensus Guideline on Margins for Breast-Conserving Surgery With Whole-Breast Irradiation in Ductal Carcinoma in Situ », Practical Radiation Oncology, vol. 6, no 5, , p. 287–295 (ISSN 1879-8519, PMID 27538810, Central PMCID 5070537, DOI 10.1016/j.prro.2016.06.011, lire en ligne)
- ↑ « Soltamox (tamoxifen) dosing, indications, interactions, adverse effects, and more », sur reference.medscape.com (consulté le 25 mai 2022)
- ↑ Sarocha Chootipongchaivat, Nicolien T. van Ravesteyn, Xiaoxue Li et Hui Huang, « Modeling the natural history of ductal carcinoma in situ based on population data », Breast cancer research: BCR, vol. 22, no 1, , p. 53 (ISSN 1465-542X, PMID 32460821, Central PMCID 7251719, DOI 10.1186/s13058-020-01287-6, lire en ligne)
- ↑ 23,0 et 23,1 (en) Vasily Giannakeas, Victoria Sopik et Steven A. Narod, « Association of a Diagnosis of Ductal Carcinoma In Situ With Death From Breast Cancer », JAMA Network Open, vol. 3, no 9, , e2017124 (ISSN 2574-3805, PMID 32936299, Central PMCID PMC7495235, DOI 10.1001/jamanetworkopen.2020.17124, lire en ligne)
- ↑ Robert E. Roses, Banu K. Arun, Sara A. Lari et Elizabeth A. Mittendorf, « Ductal carcinoma-in-situ of the breast with subsequent distant metastasis and death », Annals of Surgical Oncology, vol. 18, no 10, , p. 2873–2878 (ISSN 1534-4681, PMID 21476105, DOI 10.1245/s10434-011-1707-2, lire en ligne)
- ↑ Lindy L. Visser, Emma J. Groen, Flora E. van Leeuwen et Esther H. Lips, « Predictors of an Invasive Breast Cancer Recurrence after DCIS: A Systematic Review and Meta-analyses », Cancer Epidemiology, Biomarkers & Prevention: A Publication of the American Association for Cancer Research, Cosponsored by the American Society of Preventive Oncology, vol. 28, no 5, , p. 835–845 (ISSN 1538-7755, PMID 31023696, DOI 10.1158/1055-9965.EPI-18-0976, lire en ligne)
