Cancer appendiculaire
| Maladie | |
| Caractéristiques | |
|---|---|
| Signes | Appendicite, Ascite, Masse abdominale, Péritonisme |
| Symptômes |
Appendicite, Anorexie , Syndrome carcinoïde, Fatigue , Douleur abdominale , Asymptomatique , Vomissement , Perte de poids , Température corporelle élevée |
| Diagnostic différentiel |
Appendicite, Kyste ovarien, Abcès appendiculaire, Lymphangiome kystique, Kyste mésentérique, Kyste rétropéritonéal, Cancer ovarien, Endométriome, Diverticule de Meckel, Maladie de Crohn |
| Informations | |
| Wikidata ID | Q4781026 |
|
| |
Les tumeurs malignes appendiculaires sont un groupe rare de tumeurs souvent trouvées accidentellement lors de l'ablation chirurgicale de l'appendice. Sur le plan histologique, cette tumeur maligne représente 0,5 à 1% de tous les échantillons de pathologie après appendicectomie.[1][2] Cliniquement, cette affection se présente le plus souvent comme une appendicite aiguë due à une obstruction de la lumière appendiculaire. Comme c'est le cas pour toutes les tumeurs malignes, une détection précoce est essentielle car le diagnostic tardif pourrait nuire au pronostic.[3]
Épidémiologie
Le cancer de l'appendice est observé dans 1% des prélèvements appendiculaires[4] et a une incidence de 0,97 cas par 100 000 de population [5]. Il y a davantage de tumeurs neuroendocrines chez les jeunes patients et davantage d'adénocarcinomes chez la population plus âgée[6] Une association accrue avec la néoplasie colique et la colite ulcéreuse chronique a été notée.[2] 20% des cas ont une tumeur colorectale synchrone. Il y a aussi une association avec les tumeurs rénale, ovarienne et mammaire. L'appendice est le deuxième site le plus fréquent pour les tumeurs neuroendocrines après le rectum selon la base de données SEER. Au moment du diagnostic, plus d'un tiers des tumeurs neuroendocriniennes sont métastatiques lors du diagnostic.[7][3]
Étiologies et pathologie
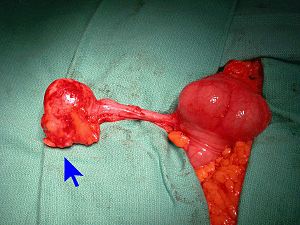
Pour comprendre l'origine tumorale, il faut comprendre les lignées cellulaires de l'appendice. La lignée épithéliale contient beaucoup de cellules à gobelet pour une production abondante exocrine de mucus. Un mucocèle est une collection de mucine épaissie accumulée par une obstruction. Celle-ci peut être causée par un processus tumoral ou non. Des tumeurs appendiculaires peuvent aussi sécréter de la mucine et causer un mucocèle. Il y a deux grandes classes de tumeurs appendiculaires, soit les tumeurs épithéliales et les tumeurs non-épithéliales.
Tumeurs épithéliales
L'OMS a récemment subdivisé les tumeurs épithéliales appendiculaires[8]. Il y a d'abord les tumeurs épithéliales mucineuses non-invasises de bas grade (LAMNs pour low grade appendiceal mucinous neoplasm). Histologiquement, il s'agit d'un adénome bien différencié. Il peut y avoir de la mucine extraluminale associée. Anciennement, ces lésions étaient communément appelées mucocèle ou cystadénome mucineux. Il y a ensuite une classe intermédiaire se situant entre le LAMN et les lésions invasives. Les LAMN de catégorie intermédiaire[9] peuvent être perforée, avoir de la fibrose pariétale, de la mucine qui dissèque la paroi ou de la mucine acellulaire dans les tissus mous péri-appendiculaires. Les néoplasies appendiculaires mucineuses de haut grade (HAMN pour high-grade appendicular mucinous neoplasm) ont les mêmes caractéristiques mais avec des atypies marquées. [10]

Pour les adénocarcinomes, 90% des néoplasies sont mucineuses et 10% sont de type intestinal - soit le ratio inverse des néoplasies coliques. Le sous-type en bague à chaton offre le moins bon pronostic. Les adénocarcinomes mucineux ont des glandes invasives avec des atypies de haut-grade et de la mucine extra-cellulaire qui occupent plus de 50% de la lésion. Les lésions expriment les marqueurs p53, CD44 et CDX2, comme leur équivalent colique. La variante avec cellules en bagues à chaton est plus agressive puisque moins bien différenciée et a davantage de métastases lymphatiques. Finalement, il y a un sous-type de tumeurs qui est un mélange entre les tumeurs épithéliales et les tumeurs neuroendocrines. Il s'agit des tumeurs adénocarcinoïdes ; une tumeur des cellules à gobelet qui expriment de la chromogranine-A. Son pronostic est moins bon que les tumeurs non-épithéliales et doit donc être pris en charge comme un adénocarcinome. [11] Les mécanismes qui entraînent des tumeurs malignes appendiculaires ne sont pas bien compris. Cependant, il a été postulé que les néoplasmes mucineux appendiculaires (AMN, un sous-ensemble majeur de tumeurs appendiculaires) suivent la même séquence adénome-carcinome que celle observée dans le cancer colorectal. Cette séquence commence par une mutation ponctuelle dans le proto-oncogène KRAS puis des mutations et / ou des délétions dans le gène TP53 sur Chr 17p. Ensuite, des mutations tronquées sur le gène APC sur 5q et le gène bêta-caténine contribuent toutes à son apparition. Une théorie alternative de l'instabilité des microsatellites (MSI) a été postulée comme résultant de mutations dans les gènes de réparation des mésappariements nucléotidiques, par exemple hMSH2, hMLH1, PMS1, PMS2 et GTBP.[12][13][14][3]

Tumeur non-épithéliales
Les tumeurs non-épithéliales sont surtout des tumeurs neuroendocrines. 18% des tumeurs neuroendocrines digestives touchent l'appendice. 75% sont situés au tiers distal, 95% ont moins de 2 cm, 10% sont symptomatiques. Les tumeurs sont rarement multicentriques (4,5%). Les tumeurs neuroendocrines ont une séquence cancéreuse différente. séquence à trouver et référencer[Référence nécessaire] Comme l'appendice est principalement un tissu lymphoïde, des lymphomes appendiculaires peuvent survenir. L'étiologie est un lymphome de Burkitt avec un âge moyen de 18 ans et des lymphomes diffus à grandes cellules B chez le sujet âgé. [15][3] Finalement, les sarcomes et les GIST sont également possibles.

Physiopathologie
L'obstruction de la lumière appendiculaire par les cellules malignes entraîne une inflammation de l'appendice, une stase veineuse et, finalement, une infection de l'appendice.[16] Dans les tumeurs mucineuses de l'appendice, il peut y avoir une dilatation kystique de l'appendice due à l'obstruction de la lumière appendiculaire avec création d'un mucocèle.[17][18] Ces processus sont à la base de la présentation clinique la plus courante de cette maladie, l'appendicite aiguë.[3] Quant aux tumeurs neuroendocrines, elles sont souvent trouvées fortuitement dans le spécimen d'une appendicite aiguë.
Présentation clinique
Dans plus de 50% des cas, il n'y a aucun symptôme, et cette malignité est détectée accidentellement. Cependant, la plupart des patients symptomatiques se présenteraient sous forme d'appendicite aiguë.[19][1] Les facteurs qui devraient augmenter la suspicion de néoplasie appendiculaire comprennent un âge supérieur à 50 ans avec des antécédents familiaux de cancer du côlon ou de maladie inflammatoire de l'intestin (MII), des caractéristiques évocatrices d'une appendicite chronique ou la présence d'une anémie inexpliquée [16] Le patient peut présenter des douleurs abdominales non spécifiques, des douleurs du quadrant inférieur droit, une perte de poids, une anorexie, de la fièvre, des vomissements, des caractéristiques d'obstruction intestinale et de la fatigue.[17] Dans le cadre d'une tumeur neuroendocrine, un syndrome carcinoïde est également possible avec une charge métastastique au foie. L'examen physique peut révéler une sensibilité abdominale du quadrant inférieur droit avec de la défense si le patient se présente en appendicite, une masse abdominale, la présence d'ascite ou les caractéristiques de la maladie métastatique.[3]
Facteurs de risque
Les mêmes facteurs de risque de l'adénocarcinome colique s'appliquent à ceux de l'appendice, excluant les tumeurs neuroendocrines.
Questionnaire
On doit questionner le patient tel une appendicite s'il se présente à l'urgence. Si le patient est vu en clinique, le patient doit être questionné sur son état général et sa digestion. Il est a noté que le mucocèle est souvent asymptomatique et découvert fortuitement sur l'imagerie.
Examen clinique
Le patient est examiné au niveau abdominal, incluant un toucher rectal. On recherche un tableau d'irritation péritonéale si le patient est en appendicite. Sinon, on recherche l'effet de masse au quadrant inférieur droit ou de l'ascite. La recherche d'adénopathies est également suggérée.
Examens paracliniques
Imagerie :
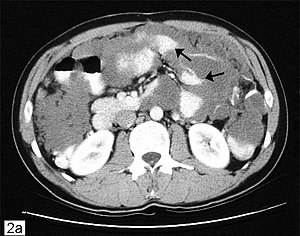
Les études d'imagerie constituent le pilier de l'évaluation initiale. Pour les mucocèles, les résultats échographiques comprennent des lésions allongées ou kystiques dans le quadrant inférieur droit (RLQ) avec des caractéristiques d'apparence interne en pelure d'oignon représentant une mucine lamellée, ce qui est une découverte pathognomonique.[17] Un défaut de la paroi appendiculaire avec fuite peut être le signe d'une rupture du mucocèle [17] Chez les patients présentant des caractéristiques d'appendicite aiguë, une tomodensitométrie ou une IRM révélant un appendice de plus de 15 mm avec des parois épaissies ou irrégulières est suspect pour une néoplasie.[20] Un nodule rehaussant dans la paroi est évocateur d'un adénocarcinome. S'il y a des bulles d'air dans le mucocèle, celui-ci est probablement surinfecté. Les radiographies simples de l'abdomen ont peu de valeur clinique et peuvent montrent rarement une calcification curviligne à la fosse iliaque droite. Les dépôts mucineux d'un pseudomyxome peritonei peuvent être identifiés facilement à la tomodensitométrie.
Des imageries spécifiques des tumeurs neuroendocrines ne sont pas nécessaires mais peuvent être un complément d'information pour évaluer la maladie métastatique. La plupart des tumeurs neuroendocrines appendiculaires expriment les récepteurs à la somatostatine et donc une scintigraphie peut identifier les foyers actifs. Le PET-scan peut être utilisé pour la maladie métastastique. Le (68Ga)-dotatate PET-scan est encore plus spécifique et peut détecter jusqu'à 65% de lésions occultes non vues à la scintigraphie à la somatostatine.[21]
Analyses de laboratoire :
Tumeur épithéliale :
On dose les marqueurs tumoraux suivants lors du diagnostic. Leur valeur prédictive de récidive, de rémission ou de progression n'ont pas été établi[22]. Ils sont néanmoins utilisé pour monitorer la réponse au traitement.
- Antigène carcinoembryonnaire : On dose l'antigène carcinoembryonnaire (CEA) lorsqu'il s'agit d'une tumeur épithéliale maligne comme on le ferait pour un cancer colorectal du reste du cadre colique.[22]
- CA-125 : Un dosage normal lors du diagnostic est favorable et prédit la capacité à faire une cytoréduction complète dans le cadre d'une atteinte péritonéale.[23]
- CA 19-9 : Un dosage de base élevé est un facteur de mauvais pronostic indépendant de survie sans progression et peut être utilisé pour déterminer la récidive après une chirurgie de cytoréduction et chimiothérapie intra-péritonéale. [23][24]
Tumeurs neuroendocrines :
Les tumeurs neuroendocrines ne sont pas souvent biochimiquement actives à moins d'avoir une charge métastatique significative particulièrement au niveau hépatique. On dose la chromogranine-A et les 5-HIAA urinaires sur 24h. Des valeurs élevées sont associées à un moins bon pronostic. Ces marqueurs ne sont toutefois pas utiles au diagnostic ou pour guider le plan de traitement.[22]
Colonoscopie :
Nous devons faire une colonoscopie en pré-opératoire lorsque le diagnostic est connu par l'imagerie[22]. Si on découvre plutôt le diagnostic en per-opératoire, on doit compléter l'investigation par une colonoscopie 4 à 6 semaines post-opératoire. En effet, il peut y avoir une atteinte du bas fond cécal ou une lésion synchrone colique. La trouvaille classique du mucocèle appendiculaire est l'apparence en volcan avec écoulement de mucine possible. On trouve des adénomes synchrones dans 13% des coloscopies effectuées par les patients avec tumeurs épithéliales[25]. Inversement, on trouve moins de 4% d'adénome appendiculaire chez les patients avec cancer colorectal du reste du cadre colique[26]. Les tumeurs neuroendocrines appendiculaires sont rarement associées à d'autres tumeurs neuroendocrines synchrones, mais elles ont un taux élevé d'adénome ou d'adénocarcinome colorectal. [27]
Approche clinique
Les buts de l'intervention chirurgicale d'une néoplasie mucineuse sont les suivants :
- Diminuer le risque de perforation de la mucocèle (avoir un seuil de conversion en laparotomie bas)
- Évaluer le mésoappendice
- Évaluer le reste de la cavité abdominale : éliminer collections mucineuses
- Évaluer pour tumeur synchrone
- Lavage extensif pour diminuer implantation et faire diagnostic cytologique
Il est à noter que cette approche est idéalement faite par des chirurgiens-oncologues. S'il s'agit d'une découverte fortuite lors d'une appendicectomie pour appendicite en urgence, les principes demeurent et on documente le plus possible pour en faire part au surspécialiste qui établira la conduite finale à la lumière de la pathologie définitive.
L'approche clinique pour une tumeur neuroendocrine est sensiblement la même, soit évaluer le mésoappendice pour son envahissement ou l'atteinte lymphatique, la charge ganglionnaire et faire le bilan d'extension pour la maladie métastatique.
Diagnostic différentiel
Une masse kystique appendiculaire peut être confondue avec l'une des conditions suivantes
- appendicite aiguë ou un abcès appendiculaire
- lymphangiome kystique
- kyste mésentérique
- kyste rétropéritonéal
- kyste de l'ovaire
- cancer de l'ovaire
- diverticule de Meckel
- une maladie de crohn compliquée
- endométriome
Une néoplasie neuroendocrine solide de l'appendice peut être confondue avec toute pathologie cécale (crohn ou cancer), toute pathologie appendiculaire (l'appendicite le plus fréquemment) ou d'autres néoplasies appendiculaires solides (lymphome, adénocarcinome de type intestinal, sarcome, métastases).
Traitement
La thérapie chirurgicale est le pilier de la thérapie des cancers de l'appendice; cependant, les cas avancés avec métastases à distance peuvent être chirurgicalement non résécables. L'appendicectomie avec une large résection du mésoappendice afin d'exclure l'atteinte des ganglions lymphatiques peut être à la fois diagnostique et curative pour la plupart des tumeurs appendiculaires.[28] D'autres modalités chirurgicales telles qu'une hémicolectomie droite sont indiquées en cas d'atteinte ganglionnaire, une grosse tumeur neuroendocrine avec des marges floues et une invasion méso-appendiculaire de plus de 3 mm [29]
- Mucocèle appendiculaire
Ø Accumulation intra-luminale de matériel mucoïde.
Ø Obstruction par adénome vs adénocarcinome mucineux.
Ø ≤ 2 cm = rarement malin
Ø Traitement :
§ Appendicectomie LSC vs ouverte
§ Exérèse du mésoappendice
Ø Principes :
§ Éviter rupture (re : risque de pseudomyxome)
o Approche LSC acceptable
o Seuil de conversion bas
§ Évaluation du mésoappendice pour envahissement et ADP.
- Adénocarcinome in situ
o Appendicectomie suffisante si résection en marge saine
o
- Adénocarcinome invasif
o Hemi-colectomie droite de complétion si tumeur > 1 cm (Sabiston).
TRAITEMENTS : CARCINOÏDES
- Si tumeur ≤ 1 cm
o Appendicectomie seule +/- ceacectomie partielle si atteinte de la base
- Tumeur entre 1-2 cm
o Devrait être discutée en clinique de tumeur
o Appendicectomie seule +/- ceacectomie partielle si atteinte de la base.
o SAUF SI :
§ Envahissement du mesoappendice
§ Infiltration lympho-vasculaire
§ Index mitotique élevé (Ki-67 ≥ 3%)
§ Adénopathie(s) +
- Tumeur ≥ 2 cm
o Hemi-colectomie droite
o Métastases ganglionnaires ad 30% des cas
Une prise en charge plus détaillée du pseudomyxome peritonei est abordée ici. La chirurgie cytoréductive et la chimiothérapie intrapéritonéale sont particulièrement utiles dans les tumeurs mucineuses de l'appendice. Les tumeurs épithéliales de l'appendice non résécables chirurgicalement avec métastases à distance peuvent bénéficier d'une chimiothérapie comme le cancer colorectal métastatique.[3]
Suivi
Tumeur épithéliale de bas grade: Il n'y a pas de lignes directrices officielles, mais il est suggéré de faire un minimum de 2 ans de suivi car il y a un faible risque de développer un pseudomyxome péritonéi. Un CT-scan aux 6 mois pour 2 ans est donc suggéré.[22]
Tumeur épithéliale maligne : Une approche de suivi plus agressive est suggérée et se rapproche de celle utilisée pour le suivi des cancers colorectaux, soit une imagerie aux 4 à 6 mois pour 2 ans, puis aux années pour au moins un total de 5 ans. Les marqueurs sont également dosés. [22]
Tumeur neuroendocrine : il n'y a aucune ligne directrice standardisée car les séries sont trop petites pour établir des recommandations claires. Il est suggéré de faire des suivis aux 6 à 12 mois, mais pour une durée allant jusqu'à 10 ans après une résection curative. Le tout est modulé selon le degré d'agressivité de la lésion initiale. On dose aussi les marqueurs tumoraux que l'on pourra corréler à une imagerie ciblée. [22]
Complications
Toute contribution serait appréciée.
| Description: | Cette section traite des complications possibles de la maladie. |
| Formats: | Liste à puces, Texte |
| Balises sémantiques: | Complication |
| Commentaires: |
|
| Exemple: | Les complications de l'infarctus du myocarde sont :
|
Pseudomyxoma peritonei (PMP) représente la croissance de cellules néoplasiques productrices de mucines dans la cavité péritonéale avec une ascite mucineuse résultante. La PMP peut être le stade de présentation pour une majorité de patients et est classée en fonction du grade comme adénomucinose péritonéale disséminée (DPAM) associée à LAMN et a moins de figures mitotiques et de cellules épithéliales simples et une adénocarcinomatose mucineuse péritonéale de haut grade (PMAC) généralement associée à adénocarcinome mucineux.[6][30][16].[3]
Des adhérences et une obstruction intestinale peuvent généralement survenir dans le cadre d'une maladie métastatique.[31] Métastases ovariennes et rétropéritonéales ainsi qu'hydroureteronephrosis, une complication rare peut survenir.[32][33][3]
Évolution
Si la section est n'est pas jugée nécessaire, elle peut être supprimée.
| Description: | Cette section contient le pronostic et évolution naturelle de la maladie. Le pronostic est lié à la survie du patient atteint de la maladie. L'évolution naturelle est la manière dont évoluera la maladie du patient dans le temps. |
| Formats: | Texte |
| Balises sémantiques: | |
| Commentaires: | |
| Exemple: | La dissection aortique est associée une mortalité très élevée. Au moins 30% des patients décèdent après leur arrivée à l'urgence, et ce, même après une intervention chirurgicale. Pour ceux qui survivent à la chirurgie, la morbidité est également très élevée et la qualité de vie est mauvaise. La mortalité la plus élevée d'une dissection aortique aiguë est dans les 10 premiers jours. Les patients qui ont une dissection chronique ont tendance à avoir un meilleur pronostic, mais leur espérance de vie est raccourcie par rapport à la population générale.[1] Sans traitement, la mortalité est de 1 à 3% par heure au cours des 24 premières heures, 30% à une semaine, 80% à deux semaines et 90% à un an. |
Le pronostic dépend du type histologique, du stade avancé et du grade, de la propagation de la mucine au-delà du RLQ ainsi que de la présence de mucine cellulaire.[17] Les taux de survie à cinq ans varient de 27% à 93%. Les tumeurs à cellules en anneau ont le pire pronostic (27%) tandis que les tumeurs neuroendocriniennes sont les plus favorables (93%). [34] Le taux de survie à 10 ans pour l'adénocarcinome mucineux est inférieur à 10% .[35][3]
Prévention
Les tumeurs appendiculaires présentent habituellement cliniquement des caractéristiques d'appendicite aiguë et sont souvent diagnostiquées après l'examen histologique d'un échantillon d'appendicectomie. Il est important de faire le suivi de l'examen histologique des échantillons d'appendicectomie pour s'assurer que les tumeurs de l'appendice ne sont pas manquées.
Références
- Cette page a été modifiée ou créée le 2020/09/21 à partir de Appendix Cancer (StatPearls / Appendix Cancer (2020/07/05)), écrite par les contributeurs de StatPearls et partagée sous la licence CC-BY 4.0 international (jusqu'au 2022-12-08). Le contenu original est disponible à https://www.ncbi.nlm.nih.gov/pubmed/32310403 (livre).
- ↑ 1,0 et 1,1 https://www.ncbi.nlm.nih.gov/pubmed/12740466
- ↑ 2,0 et 2,1 https://www.ncbi.nlm.nih.gov/pubmed/28663356
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 3,7 3,8 et 3,9 https://www.ncbi.nlm.nih.gov/pubmed/32310403
- ↑ S. J. Connor, G. B. Hanna et F. A. Frizelle, « Appendiceal tumors », Diseases of the Colon & Rectum, vol. 41, no 1, , p. 75–80 (ISSN 0012-3706, DOI 10.1007/bf02236899, lire en ligne)
- ↑ S. J. Connor, G. B. Hanna et F. A. Frizelle, « Appendiceal tumors », Diseases of the Colon & Rectum, vol. 41, no 1, , p. 75–80 (ISSN 0012-3706, DOI 10.1007/bf02236899, lire en ligne)
- ↑ 6,0 et 6,1 https://www.ncbi.nlm.nih.gov/pubmed/26270447
- ↑ https://www.ncbi.nlm.nih.gov/pubmed/25560182
- ↑ Syed A. Hoda et Rachel E. Kaplan, « World Health Organization (WHO) Classification of Breast Tumours, 4th ed », The American Journal of Surgical Pathology, vol. 37, no 2, , p. 309–310 (ISSN 0147-5185, DOI 10.1097/pas.0b013e318273b19b, lire en ligne)
- ↑ K. F. Fournier, R. Royal, L. A. Lambert et M. Taggart, « Mucinous appendiceal tumors of uncertain malignant potential (UMP): Prognostic factors and implications for treatment and follow-up. », Journal of Clinical Oncology, vol. 29, no 4_suppl, , p. 372–372 (ISSN 0732-183X et 1527-7755, DOI 10.1200/jco.2011.29.4_suppl.372, lire en ligne)
- ↑ Norman J Carr, Frederic Bibeau, Robert F Bradley et Peggy Dartigues, « The histopathological classification, diagnosis and differential diagnosis of mucinous appendiceal neoplasms, appendiceal adenocarcinomas and pseudomyxoma peritonei », Histopathology, vol. 71, no 6, , p. 847–858 (ISSN 0309-0167, DOI 10.1111/his.13324, lire en ligne)
- ↑ Shayna Brathwaite, Jonathan Rock, Martha M. Yearsley et Tanios Bekaii-Saab, « Mixed Adeno-neuroendocrine Carcinoma: An Aggressive Clinical Entity », Annals of Surgical Oncology, vol. 23, no 7, , p. 2281–2286 (ISSN 1068-9265 et 1534-4681, DOI 10.1245/s10434-016-5179-2, lire en ligne)
- ↑ https://www.ncbi.nlm.nih.gov/pubmed/8640546
- ↑ https://www.ncbi.nlm.nih.gov/pubmed/7674315
- ↑ https://www.ncbi.nlm.nih.gov/pubmed/10982779
- ↑ https://www.ncbi.nlm.nih.gov/pubmed/3811021
- ↑ 16,0 16,1 et 16,2 Erreur de référence : Balise
<ref>incorrecte : aucun texte n’a été fourni pour les références nommées:7 - ↑ 17,0 17,1 17,2 17,3 et 17,4 https://www.ncbi.nlm.nih.gov/pubmed/23439060
- ↑ https://www.ncbi.nlm.nih.gov/pubmed/16699309
- ↑ https://www.ncbi.nlm.nih.gov/pubmed/17511043
- ↑ https://www.ncbi.nlm.nih.gov/pubmed/17374868
- ↑ Samira M. Sadowski, Vladimir Neychev, Corina Millo et Joanna Shih, « Prospective Study of 68Ga-DOTATATE Positron Emission Tomography/Computed Tomography for Detecting Gastro-Entero-Pancreatic Neuroendocrine Tumors and Unknown Primary Sites », Journal of Clinical Oncology, vol. 34, no 6, , p. 588–596 (ISSN 0732-183X et 1527-7755, DOI 10.1200/jco.2015.64.0987, lire en ligne)
- ↑ 22,0 22,1 22,2 22,3 22,4 22,5 et 22,6 Sean C. Glasgow, Wolfgang Gaertner, David Stewart et Jennifer Davids, « The American Society of Colon and Rectal Surgeons, Clinical Practice Guidelines for the Management of Appendiceal Neoplasms », Diseases of the Colon and Rectum, vol. 62, no 12, , p. 1425–1438 (ISSN 1530-0358, PMID 31725580, DOI 10.1097/DCR.0000000000001530, lire en ligne)
- ↑ 23,0 et 23,1 S. van Ruth, A. A. M. Hart, J. M. G. Bonfrer et V. J. Verwaal, « Prognostic value of baseline and serial carcinoembryonic antigen and carbohydrate antigen 19.9 measurements in patients with pseudomyxoma peritonei treated with cytoreduction and hyperthermic intraperitoneal chemotherapy », Annals of Surgical Oncology, vol. 9, no 10, , p. 961–967 (ISSN 1068-9265 et 1534-4681, DOI 10.1007/bf02574513, lire en ligne)
- ↑ F. Di Fabio, W. Aston, F. Mohamed et K. Chandrakumaran, « Elevated tumour markers are normalized in most patients with pseudomyxoma peritonei 7 days after complete tumour removal », Colorectal Disease, vol. 17, no 8, , p. 698–703 (ISSN 1462-8910, DOI 10.1111/codi.12924, lire en ligne)
- ↑ R.M. Smeenk, M.L.F. van Velthuysen, V.J. Verwaal et F.A.N. Zoetmulder, « Appendiceal neoplasms and pseudomyxoma peritonei: A population based study », European Journal of Surgical Oncology (EJSO), vol. 34, no 2, , p. 196–201 (ISSN 0748-7983, DOI 10.1016/j.ejso.2007.04.002, lire en ligne)
- ↑ Muhammad Najm Khan et Brendan J. Moran, « Four Percent of Patients Undergoing Colorectal Cancer Surgery may have Synchronous Appendiceal Neoplasia », Diseases of the Colon & Rectum, vol. 50, no 11, , p. 1856–1859 (ISSN 0012-3706, DOI 10.1007/s10350-007-9033-2, lire en ligne)
- ↑ Irvin M. Modlin, Kevin D. Lye et Mark Kidd, « A 5-decade analysis of 13,715 carcinoid tumors », Cancer, vol. 97, no 4, , p. 934–959 (ISSN 0008-543X et 1097-0142, DOI 10.1002/cncr.11105, lire en ligne)
- ↑ https://www.ncbi.nlm.nih.gov/pubmed/10235354
- ↑ https://www.ncbi.nlm.nih.gov/pubmed/21970481
- ↑ https://www.ncbi.nlm.nih.gov/pubmed/31069398
- ↑ https://www.ncbi.nlm.nih.gov/pubmed/1609724
- ↑ https://www.ncbi.nlm.nih.gov/pubmed/28598731
- ↑ https://www.ncbi.nlm.nih.gov/pubmed/18291037
- ↑ https://www.ncbi.nlm.nih.gov/pubmed/12115365
- ↑ https://www.ncbi.nlm.nih.gov/pubmed/19641451
