Surrénalectomie
| Procédure | |||
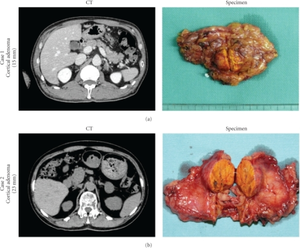 TDM pré-opératoire et spécimens post-opératoires (surrénalectomie gauche) | |||
| Procédure | |||
|---|---|---|---|
| Système | Endocrinologie, Urologie | ||
| Informations | |||
| Terme anglais | adrenalectomy | ||
| Wikidata ID | Q366774 | ||
| Spécialités | Chirurgie générale, Urologie, Endocrinologie, Oncologie | ||
| |||
La surrénalectomie consiste à retirer la ou les glandes surrénales par une approche en laparoscopie ou en laparotomie.
Indications

Les indications cliniques de la surrénalectomie en laparoscopie incluent[1][2][3][4]:
- une masse surrénalienne fonctionnelle ou non fonctionnelle identifiée au bilan préopératoire
- un hyperaldostéronisme primaire
- un phéochromocytome
- un syndrome de Cushing surrénalien
- un syndrome de Cushing réfractaire à la thérapie ciblée hypophysaire
- un syndrome de Cushing ectopique avec site primitif inconnu ou inopérable
- une masse surrénalienne > 4 cm sur l'imagerie préopératoire
- un carcinome corticosurrénalien ou une tumeur métastatique.
Les indications cliniques de la surrénalectomie en laparotomie incluent [5] :
- une tumeur corticosurrénalienne (> 6-8 cm)
- une invasion cancéreuse locale suspectée à la tomodensitométrie
- un phéochromocytome (> 8-10 cm)
- une tumeur surrénalienne envahissant une structure veineuse majeure.
Une conversion de laparoscopie en laparotomie est indiquée si :
- une complication intra-opératoire survient et ne peut être résolu laparoscopiquement (ex. saignements incontrôlables)
- la tumeur risque une fragmentation/spillage lors de son retrait
- des signes macroscopiques de malignité sont observés (ex. lymphadénopathie régionale).
Contre-indications
Absolues à la surrénalectomie
Les contre-indications absolues sont [3][6]:
- une coagulopathie (sévère)
- un phéochromocytome métastatique aux ganglions périaortiques
- une mauvaise condition cardiovasculaire.
Relatives à la surrénalectomie par laparoscopie
Les contre-indications relatives sont [3] :
- une tumeur de grande taille (> 6-8 cm)
- la carcinome corticosurrénalien
- un envahissement extrasurrénalien.
Relatives à la surrénalectomie par laparotomie
Les contre-indications relatives sont des antécédents chirurgicaux abdominaux (à la discrétion de l'équipe chirurgicale)[5].
Anatomie

Relation anatomique
Les glandes surrénales droite et gauche sont situées dans le fascia de Gerota adjacent aux reins.[7]
| Glande surrénale | Surface | |
|---|---|---|
| Droite | Antérieure |
|
| Postérieure |
| |
| Gauche | Antérieure |
|
| Postérieure |
|
Vascularisation
L'apport artériel des glandes surrénales est constitué de petites branches artérielles issues de l'artère phrénique inférieure (pôle supérieure de la glande), de l'aorte (portion moyenne de la glande) et des artères rénales (pôle inférieur de la glande). Des branches issues de l'artère urétérale supérieure sont possibles. Globalement, la surrénale est perfusée par une cinquantaine de petites branches artérielles[7]. Le drainage veineux de la glande surrénale gauche se fait vers la veine rénale gauche par la veine surrénale gauche, tandis que la veine surrénale droite se draine directement dans la veine cave inférieure.[3] Le drainage lymphatique se fait via un plexus subcapsulaire extensif qui se draine autour des veines surrénaliennes, puis vers les ganglions des veines rénales, les ganglions paraaortiques et aussi vers les chaînes médiastinales via les orifices des nerfs splanchniques[7].
Fonction
La glande surrénale est composée de deux couches distinctes, le cortex surrénalien externe et la médullosurrénale interne, qui ont une production hormonale distincte.[3]
La médullosurrénale est constituée de cellules ectodermiques provenant de la crête neurale et est le site de production de catécholamines, qui comprend la dopamine, la norépinéphrine et l'épinéphrine.[3]
Le cortex surrénalien est divisé en trois zones (de superficielle à profonde) [3]:
- la zona glomerulosa (production des minéralocorticoïdes (aldostérone))
- la zona fasiculata (production de glucocorticoïdes (cortisol))
- la zona reticularis (production d'androgènes (DHEA-S, DHEA et androstènedione)).
Évaluation
La tomodensitométrie abdominale et l'imagerie par résonance magnétique identifient la masse surrénalienne. Pour établir un diagnostic plus précis, l'aspiration à l'aiguille fine est généralement préférée à la biopsie, car les glandes surrénales sont difficilement accessibles entre le foie et le rein droit ou la rate et le rein gauche. Des antécédents de cancer peuvent toutefois suggérer la biopsie pour éliminer des métastases.[8] L'imagerie permet également d'évaluer la vascularisation en vue du geste opératoire.
Avec l'amélioration des techniques d'imageries axiales, il y a eu une augmentation du nombre de masses surrénaliennes (incidentalome surrénalien). Les tumeurs surrénales nécessitent un bilan pour déterminer si elles sont hormonalement fonctionnelles, malignes ou métastatiques. Les patients atteints de tumeurs surrénaliennes hormonalement fonctionnelles doivent bénéficier d'une optimisation préopératoire ciblée, en plus de l'optimisation de routine adaptée à l'âge et aux comorbidités.[9][2][3]
Lors de la planification d'une surrénalectomie, les considérations relatives aux changements hormonaux et à la préparation préopératoire de ces changements sont aussi importantes et exigent autant d'attention du chirurgien que les aspects techniques du cas.[3]
Les patients présentant un hyperaldostéronisme au bilan biochimique doivent subir un prélèvement veineux surrénalien pour confirmer la latéralisation de la glande surrénale affectée, car l'imagerie préopératoire peut être trompeuse dans de nombreux cas. [3]
Préparation
La préparation préopératoire des patients subissant une surrénalectomie est de la plus haute importance. Le bilan doit inclure un bilan biochimique pour déterminer si un nodule ou une masse sécrétant de l'aldostérone, du cortisol ou des catécholamines est présent.[3]
En cas de phéochromocytome, les patients doivent être initialement sous alpha-bloqueurs jusqu'à l'obtention d'une hypotension orthostatique, avec l'ajout d'un bêta-bloqueurs si nécessaire. L'hydratation préopératoire et la réplétion électrolytique doivent également être effectuées par le biais d'un régime alimentaire riche en sodium et augmenter l'apport hydrique la semaine précédant la chirurgie.[3]
Spécificités pour la laparotomie
En pré-opératoire, la laparotomie nécessite aussi [5] :
- une prophylaxie pour la thrombose veineuse profonde avec héparine de bas poids moléculaire (ex. Daltéparine, Clexane, Fragmin)
- une antibiothérapie prophylactique pour les patients avec le syndrom de Cushing.
Équipement
L'équipement à préparer comprend les éléments suivants [3]:
- une canule artérielle et un voie centrale pour les surrénalectomies droites, les phéochromocytomes ou les personnes à risque cardiovasculaire accru
- une anesthésie générale avec intubation endotrachéale
- un cathéter de Foley et des antibiotiques préopératoires ne sont pas nécessaires.
Techniques
Surrénalectomie transabdominale laparoscopique
| Explications | |
|---|---|
| Positionnement |
|
| Étapes communes |
|
| Pour la surrénale gauche |
|
| Pour la surrénale droite |
|
-
Surrénalectomie gauche (chirurgie laparoscopique)
-
Technique chirurgicale (surrénalectomie gauche)
Surrénalectomie rétropéritonéoscopique postérieure
| Explications | |
|---|---|
| Positionnement |
|
| Étapes communes |
|
| Surrénale droite |
|
| Surrénale gauche |
|
Surrénalectomie par laparotomie
| Explications | |
|---|---|
| Positionnement |
|
| Étapes communes |
|
| Surrénale droite |
|
| Surrénale gauche |
|
Complications
Les facteurs de risques associés aux complications de la surrénalectomie sont [4] :
- l'âge
- l'obésité (IMC ≥ 30) (dépend des études)
- des antécédents de chirurgie rétropéritonéale ou mésocolique haute
- la taille de la tumeur (≥ 4,5 cm et ≥ 6 cm selon les études)
- la présence d'un phéochromocytome
- la présence de comorbidités
- une tumeur maligne surrénalienne.
Les complications de la surrénalectomie sont [6] :
- des hémorragies (si elles sont trop importantes lors de l'opération laparoscopique, on passe à une opération ouverte)
- la lacération hépatique, la lacération splénique, la lacération diaphragmatique et aux autres organes intra-abdominaux.
Les complications de la procédure chirurgicale bilatérale sont [3][10][11][12][13][14] :
- l'insuffisance surrénalienne primaire[note 2]
- l'hypercorticisme[note 3]
- une crise surrénalienne
- le développement du syndrome de Nelson (tumeur corticotrope agressive)[note 4]
- l'hypocorticisme iatrogénique.
Suivi
Le suivi dépend essentiellement de la cause sous-jacente, mais certains éléments sont communs dans la majeure partie des cas. Il est primordial [1][4][15][16] :
- de surveiller la tension artérielle
- d'administrer une thromboprophylaxie pendant 4-6 semaines
- d'évaluer l'axe hypothalamo-hypophyso-surrénalien en monitorant les concentrations d'aldostérone, de cortisol et de rénine
- une évaluation annuelle par un endocrinologue et/ou un oncologue est fortement conseillé pour tous patients ayant subis une surrénalectomie pour une masse, et ce, pour une période de 10 ans.
Pour le suivi d'une surrénalectomie en laparotomie [5] :
- La prophylaxie pour la thrombose veineuse profonde continue après la chirurgie, sans oublier l'importance de l'activation rapide du patient
- Pour le syndrome de Cushing, les stéroides intraveineux sont remplacés par des stéroides oraux (ex. hydrocortisone 20-20-10 mg/jour, diminution de 5 mg/jour à chaque 3-5 jours) lorsque le patient recommence à s'alimenter.
Voici quelques spécificités en lien avec certaines maladies. [1][15][16]
- Pour un phéochromocytome, il est aussi important de surveiller le rythme cardiaque et la glycémie pendant les deux premiers jours post-opératoires
- Pour un aldostéronisme primaire, les recommandations suggèrent aussi de monitorer les concentrations de potassium et de créatinine, en plus de suspendre les suppléments en potassium et les antagonistes des récepteurs minéralocorticoïdes. Tous les ions mentionnés devraient être mesurées dans la première année pour évaluer le traitement post-opératoire.
- Pour un syndrome de Cushing, l'administration de glucocorticoïdes (10–12 mg/m2 par jour, répartis en deux ou trois doses) sont indiquées jusqu'au rétablissement de l'axe hypothalamo-hypophyso-surrénalien. Les doses doivent être modifiées dans les situations stressantes.
- Pour les patients ayant été opérés en raison d'une masse surrénale affectant les niveaux de cortisol à la hausse, ils devraient se voir prescrire des glucocorticoïdes et minéralocorticoïdes à vie pour substituer à l'axe hypothalamo-hypophyso-surrénalien.
Notes
- ↑ Pour de plus amples directives, veuiller vous référer à la référence [5]
- ↑ L'insuffisance surrénalienne primaire survient après une surrénalectomie bilatérale. Les signes et symptômes sont une hypovolémie, une hypotension, une hyponatrémie, une hyperkaliémie, de la fièvre, des douleurs abdominales. Les patients sont pris en charge par une thérapie substitutive à base de glucocorticoïdes (hydrocortisone ou cortisone), de minéralocorticoïdes (fludrocortisone) en cas de déficit confirmé en corticoïdes ou en aldostérone, respectivement.
- ↑ L'hypercorticisme serait dû à une stimulation excessive par l'ACTH du tissu surrénalien résiduel.
- ↑ Le syndrome de Nelson est moins fréquent et est généralement associé à une hyperpigmentation cutanée due à une hypersécrétion de produits de proopiomélanocortine (POMC).
Références
- Cette page a été modifiée ou créée le 2023/01/10 à partir de Adrenalectomy (StatPearls / Adrenalectomy (2022/07/25)), écrite par les contributeurs de StatPearls et partagée sous la licence CC-BY 4.0 international (jusqu'au 2022-12-08). Le contenu original est disponible à https://www.ncbi.nlm.nih.gov/pubmed/32644519 (livre).
- Cet article a été créé en partie ou en totalité le 2023-01-10 à partir de Chirurgie (application), créée par Dre Hélène Milot, Dr Olivier Mailloux et collaborateurs et partagé sous la licence CC-BY-SA 4.0 international
- ↑ 1,0 1,1 et 1,2 Martha A. Zeiger, Stanley S. Siegelman et Amir H. Hamrahian, « Medical and surgical evaluation and treatment of adrenal incidentalomas », The Journal of Clinical Endocrinology and Metabolism, vol. 96, no 7, , p. 2004–2015 (ISSN 1945-7197, PMID 21632813, DOI 10.1210/jc.2011-0085, lire en ligne)
- ↑ 2,0 et 2,1 Martha A. Zeiger, Geoffrey B. Thompson, Quan-Yang Duh et Amir H. Hamrahian, « American Association of Clinical Endocrinologists and American Association of Endocrine Surgeons Medical Guidelines for the Management of Adrenal Incidentalomas: executive summary of recommendations », Endocrine Practice: Official Journal of the American College of Endocrinology and the American Association of Clinical Endocrinologists, vol. 15, no 5, , p. 450–453 (ISSN 1934-2403, PMID 19632968, DOI 10.4158/EP.15.5.450, lire en ligne)
- ↑ 3,00 3,01 3,02 3,03 3,04 3,05 3,06 3,07 3,08 3,09 3,10 3,11 3,12 3,13 3,14 et 3,15 Amy Y. Li et Sophie Dream, StatPearls, StatPearls Publishing, (PMID 32644519, lire en ligne)
- ↑ 4,0 4,1 4,2 et 4,3 Marco Raffaelli, Carmela De Crea et Rocco Bellantone, « Laparoscopic adrenalectomy », Gland Surgery, vol. 8, no S1, , S41–S52 (PMID 31404184, Central PMCID PMC6646817, DOI 10.21037/gs.2019.06.07, lire en ligne)
- ↑ 5,0 5,1 5,2 5,3 et 5,4 (en) Radu Mihai, « Open adrenalectomy », Gland Surgery, vol. 8, no Suppl 1, , S28–S2S35 (ISSN 2227-8575 et 2227-684X, PMID 31404196, Central PMCID PMC6646811, DOI 10.21037/gs.2019.05.10, lire en ligne)
- ↑ 6,0 6,1 et 6,2 Scott-Conner, Carol E. H., The SAGES manual : fundamentals of laparoscopy, thoracoscopy, and GI endoscopy, Springer, (ISBN 978-0-387-30485-4, 0-387-30485-1 et 0-387-23267-2, OCLC 262691450, lire en ligne)
- ↑ 7,0 7,1 7,2 et 7,3 (en) Skandalakis et al., Surgical Anatomy and Techniques : a pocket manual (ISBN 978-0-387-09514-1)
- ↑ (en) J. Willatt, S. Chong, J. A. Ruma et J. Kuriakose, « Incidental Adrenal Nodules and Masses: The Imaging Approach », International Journal of Endocrinology, vol. 2015, , p. 1–6 (ISSN 1687-8337 et 1687-8345, PMID 26064109, Central PMCID PMC4429195, DOI 10.1155/2015/410185, lire en ligne)
- ↑ J. Willatt, S. Chong, J. A. Ruma et J. Kuriakose, « Incidental Adrenal Nodules and Masses: The Imaging Approach », International Journal of Endocrinology, vol. 2015, , p. 410185 (ISSN 1687-8337, PMID 26064109, Central PMCID 4429195, DOI 10.1155/2015/410185, lire en ligne)
- ↑ Changwei Ji, Qun Lu, Wei Chen et Feifei Zhang, « Retrospective comparison of three minimally invasive approaches for adrenal tumors: perioperative outcomes of transperitoneal laparoscopic, retroperitoneal laparoscopic and robot-assisted laparoscopic adrenalectomy », BMC urology, vol. 20, no 1, , p. 66 (ISSN 1471-2490, PMID 32517679, Central PMCID 7285739, DOI 10.1186/s12894-020-00637-y, lire en ligne)
- ↑ John W. Funder, Robert M. Carey, Franco Mantero et M. Hassan Murad, « The Management of Primary Aldosteronism: Case Detection, Diagnosis, and Treatment: An Endocrine Society Clinical Practice Guideline », The Journal of Clinical Endocrinology and Metabolism, vol. 101, no 5, , p. 1889–1916 (ISSN 1945-7197, PMID 26934393, DOI 10.1210/jc.2015-4061, lire en ligne)
- ↑ Damian G. Romero et Licy L. Yanes Cardozo, « Clinical Practice Guideline for Management of Primary Aldosteronism: What is New in the 2016 Update? », International Journal of Endocrinology and Metabolic Disorders, vol. 2, no 3, (ISSN 2380-548X, PMID 28018978, Central PMCID 5175479, DOI 10.16966/2380-548X.129, lire en ligne)
- ↑ Ryan M. Rochon, Tamara Gimon, W. Donald Buie et Mantaj S. Brar, « Expedited discharge in uncomplicated acute appendicitis: Decreasing the length of stay while maintaining quality », American Journal of Surgery, vol. 217, no 5, , p. 830–833 (ISSN 1879-1883, PMID 30890264, DOI 10.1016/j.amjsurg.2019.03.007, lire en ligne)
- ↑ Diana I. Ortiz, James W. Findling, Ty B. Carroll et Bradley R. Javorsky, « Cosyntropin stimulation testing on postoperative day 1 allows for selective glucocorticoid replacement therapy after adrenalectomy for hypercortisolism: Results of a novel, multidisciplinary institutional protocol », Surgery, vol. 159, no 1, , p. 259–265 (ISSN 1532-7361, PMID 26422766, DOI 10.1016/j.surg.2015.05.034, lire en ligne)
- ↑ 15,0 et 15,1 Martha A. Zeiger, Geoffrey B. Thompson, Quan-Yang Duh et Amir H. Hamrahian, « American Association of Clinical Endocrinologists and American Association of Endocrine Surgeons Medical Guidelines for the Management of Adrenal Incidentalomas: Executive Summary of Recommendations », Endocrine Practice, vol. 15, no 5, , p. 450–453 (ISSN 1530-891X, DOI 10.4158/ep.15.5.450, lire en ligne)
- ↑ 16,0 et 16,1 (en) Florentine Schreiner, Gurpreet Anand et Felix Beuschlein, « Perioperative Management of Endocrine Active Adrenal Tumors », Experimental and Clinical Endocrinology & Diabetes, vol. 127, no 02/03, , p. 137–146 (ISSN 0947-7349 et 1439-3646, DOI 10.1055/a-0654-5251, lire en ligne)