ULaval:MED-1201/Pathologie/Dommage et mort cellulaires
Le dommage cellulaire survient lorsque les cellules subissent un stress tellement sévère qu’elles ne peuvent pas ou ne peuvent plus s’adapter, lorsqu’elles sont exposées à un agent agresseur très nocif ou si elles sont porteuses d’anomalies intrinsèques.
Notions de réversibilité et d’irréversibilité
En fonction de la nature, durée et sévérité de l’agression, mais également du type, de l’état et de la résistance des cellules agressées, il est possible de passer un point de non-retour après lequel les dommages deviendront irréversibles et la mort cellulaire, inéluctable.
Études de cas
M. SB
M. SB est un policier âgé de 60 ans, qui consulte à l’urgence pour une douleur rétro-sternale. La douleur est apparue en joggant. Il raconte qu’il a déjà eu cette douleur à quelques reprises au cours des 9 derniers mois mais de moindre intensité. La douleur survenait au cours d’un effort et cessait rapidement lorsqu’il s’arrêtait pour prendre un peu de repos. Trop occupé, il n’a jamais pris le temps de consulter.
Il décrit sa douleur thoracique comme si quelqu’un était debout sur sa poitrine. Il mentionne aussi une douleur au bras gauche. Il a un surplus de poids et fume 40 cigarettes par jour depuis l’âge de 20 ans.
L’examen physique est normal sauf pour une élévation de la pression artérielle (160/100 mmHg). L’électrocardiogramme démontre des anomalies suggérant un peu d’ischémie (diminution de l’apport sanguin) cardiaque. Il n’y a pas d’élévation des enzymes cardiaques sériques (du sérum).
Diagnostic : angine stable
- Le patient reçoit une médication appropriée, gardé sous surveillance à l’urgence pendant 24 heures. Il sera revu par un cardiologue et investigué en externe.
M. FC
M. FC est un homme d’affaire âgé de 67 ans, consultant à l’urgence pour une douleur rétro-sternale. La douleur est apparue soudainement après un copieux repas au cours duquel il a discuté d’un important contrat très lucratif pour sa compagnie. Malgré qu’il soit assis et tranquille, la douleur persiste jusqu’à son arrivée à l’hôpital.
Il décrit sa douleur comme un serrement important à la poitrine avec une douleur au bras gauche. Il a un surplus de poids, fume 30 cigarettes par jour depuis l’âge de 17 ans. Il raconte que son père et un de ses frères « font du cholestérol ».
À l’examen physique, on constate qu’il est pâle, qu’il a des sudations. Il est tachycarde. Sa pression artérielle est normale. L’électrocardiogramme démontre des anomalies correspondant à un infarctus du myocarde. Le rapport de biochimie rapporte une élévation sérique des enzymes cardiaques.
Diagnostic : infarctus du myocarde.
- Le patient est transféré à l’unité coronarienne. Il subit une coronarographie et on lui installe un tuteur dans la coronaire gauche. Il reçoit une médication appropriée. Il obtient son congé de l’hôpital après quelques jours et sera suivi par un cardiologue.
Dommages réversibles
Au début, les dommages cellulaires se manifestent par des changements fonctionnels puis éventuellement morphologiques :
- Diminution de la phosphorylation oxydative
- Diminution de la production d’ATP
- Modification de l’équilibre ions (surtout sodium)/eau conduisant à une accumulation d’eau intracellulaire (œdème intra-cytoplasmique et dans les organelles).

Les dommages réversibles présentent 4 caractéristiques morphologiques :
- Œdème cytoplasmique
- Œdème des organites
- Condensation de la chromatine
- Irrégularité de la membrane plasmique
La fonctionnalité de la cellule est également diminuée.
Dommages irréversibles et mort cellulaire
On a atteint le point de non-retour. Le retour est impossible sur les plans structural et fonctionnel.
- Existe-t-il un événement biochimique critique ? Aucune réponse claire.
- Les changements morphologiques sont ceux de la mort cellulaire : nécrose ou apoptose.
- Nécrose : digestion enzymatique de la cellule et de ses organelles.
- Apoptose : dégénérescence du noyau et la cellule se désagrège en corps apoptotiques, qui seront ensuite phagocytés.
Causes des dommages cellulaires (réversibles et irréversibles)
Diminution de l’apport en oxygène :
- Totale (anoxie) ou incomplète (hypoxie).
- Ischémie : tissu qui manque d’oxygène
- Anoxie : absence d’oxygène
- Hypoxie : diminution de l’apport en oxygène
- Causes : diminution du flot sanguin (ischémie) ; oxygénation inadéquate du sang par l’insuffisance cardio-respiratoire ; diminution de la capacité du sang à transporter l’oxygène. Les globules rouges transportent l’oxygène des alvéoles pulmonaires aux organes. Le sang oxygéné va au cœur gauche (oreillette puis ventricule) puis est distribué aux organes, donc les possibilités de manque d’oxygénation sont multiples.
Agents physiques : traumatisme mécanique, températures extrêmes, radiations, chocs électriques, etc.
Agents chimiques : produits toxiques, médicaments, dioxygène en quantité importante, ions, glucose, etc.)
Agents infectieux : bactéries, virus, champignons, parasites, etc.
Réactions immunes : contre des antigènes exogènes ou endogènes/auto-antigènes
Anomalies génétiques
Problèmes nutritionnels (déficience ou excès)
Mécanismes des dommages cellulaires

Principes généraux
Les mécanismes biochimiques responsables des dommages cellulaires sont complexes. On en retient trois principes :
- La réponse cellulaire à une agression variera selon son type, sa durée et sa sévérité.
- Exemple : brûlure cutanée par une exposition prolongée au soleil vs brûlure avec un élément chauffant vs brûlure par incendie.
- Les conséquences des dommages cellulaires dépendront du type de cellule, de l’état et de ses capacités d’adaptation.
- Type de cellule : encéphalite virale vs hépatite virale (neurone est une cellule permanente, donc les séquelles seront sévères ; cellule épithéliale hépatocytaire est une cellule stable, donc les séquelles seront moins importantes)
- État : cerveau d’un enfant vs un adulte lors d’un arrêt cardiaque. Pour un adulte, 5 minutes d’arrêt cardiaque est mortel. Le cerveau d’un enfant peut supporter plus longtemps le stress d’une hypoxie ou d’une anoxie.
- Capacité d’adaptation : athérosclérose cérébrale vs cardiaque. Les vaisseaux cérébraux sont très petits. En cas d’un infarctus minime, le cœur va pouvoir s’hypertrophier dans d’autres régions pour compenser.
- Les dommages cellulaires résultent de changements fonctionnels et biochimiques dans l’une ou plusieurs des composantes cellulaires essentielles. On en distingue 5 :
- Respiration cellulaire aérobie (donc mitochondries)
- Intégrité de la membrane cellulaire et celle des organelles
- Synthèse des protéines
- Cytosquelette
- Intégrité de l’ADN (génétique)
Mécanismes biochimiques responsables des dommages cellulaires
- Diminution de la quantité d’ATP
- Dommage aux mitochondries (mitochondries importantes pour prévention de l’apoptose)
- Influx de Ca2+ et perte de l’homéostasie du calcium
- Accumulation de radicaux libres (stress oxydatif)
- Altération de la perméabilité membranaire
- Dommages à l’ADN et aux protéines
Étudions tour à tour chacun de ces phénomènes.
Déplétion en ATP
La baisse en ATP dans une cellule résulte le plus souvent d’une agression chimique (toxique) ou d’un manque d’oxygène (anoxie). Elle peut également résulter de l’action de certaines toxines (ex : cyanure).
Il existe deux méthodes de production de l’ATP chez les mammifères :
- Phosphorylation oxydative (la plus importante)
- Glycolyse anaérobique à partir du glucose et du glycogène.
La baisse des réserves en ATP à un niveau inférieur à 5-10% de la valeur normale a des effets importants sur différents systèmes critiques pour la survie de la cellule : la pompe à sodium membranaire, le métabolisme énergétique cellulaire, la synthèse des protéines, la membrane cellulaire et celle des organelles, le noyau. Le résultat est la nécrose cellulaire.
Effets de la baisse d’ATP sur les composantes critiques pour la survie de la cellule :
- Pompe à sodium membranaire : on va gagner du sodium et avoir beaucoup plus d’eau dans la cellule, d’où l’œdème. On a aussi avoir œdème des organelles. Influe aussi sur les pompes à calcium et potassium.
- Métabolisme énergétique cellulaire : augmentation de la glycolyse anaérobique, donc augmentation de la quantité d’acide lactique à baisse du pH à condensation de la chromatine.
- Synthèse des protéines : les ribosomes se détachent du réticulum endoplasmique (car la membrane de ce dernier est compromise) donc la synthèse des protéines est diminuée.
- Membrane cellulaire et celle des organelles (voir ci-dessus)
- Noyau (voir ci-dessus)
Dommage aux mitochondries
La mitochondrie est une cible importante pour plusieurs agents agresseurs (baisse de O2, toxines, toxicité chimique, radiations, etc.).
L’atteinte à l’intégrité des mitochondries résulte en une baisse de la production de l’ATP et en une hausse de formation de radicaux libres. Il y a aussi libération de facteurs pro-apoptiques.
Influx de Ca2+ et perte de l’homéostasie du Ca2+
Dans la cellule normale, il y a très peu de calcium. Celui-ci est contenu dans les mitochondries et le réticulum endoplasmique.
Ce gradient est maintenu par l’activité d’une pompe Ca2+/Mg2+ ATPase.
Une hausse du calcium intracellulaire provoque :
- Une hausse non spécifique de la perméabilité membranaire
- Une activation enzymatique causant des dommages nucléaires
- Une hausse de la perméabilité des mitochondries responsable d’une baisse de l’ATP.
Accumulation de radicaux libres (stress oxydatif)
Dans la respiration normale, le dioxygène est transformé en eau. Mais ce processus crée également d’autres dérivés, l’anion superoxyde O2-, le peroxyde d’hydrogène H2O2, le radical hypochlorique et le radical hydroxyle HO-.
Les radicaux libres, et plus particulièrement les métabolites de l’oxygène, jouent un rôle important dans le dommage cellulaire et ce, dans plusieurs conditions pathologiques.
Conditions de nature chimique, radique, ischémie-reperfusion, vieillissement cellulaire et digestion des microbes par les phagocytes.
Les radicaux libres sont des produits chimiques ayant un électron libre en orbite.
Les métabolites de l’oxygène sont produits normalement durant la respiration cellulaire. Ils sont très instables et se dégradent généralement spontanément. Il existe également des mécanismes enzymatiques et non-enzymatiques qui dégradent les métabolites de l’oxygène. Une production accrue des métabolites de l’oxygène ou une diminution de leur dégradation conduit à leur accumulation : on parle de stress oxydatif, nocif pour l’organisme. Les radicaux libres ont des effets très variés mais trois sont relatifs aux dommages cellulaires :
- Dommages aux membranes cellulaires (peroxydation des lipides)
- Fragmentation des protéines (oxydation)
- Dommages à l’ADN.
Le figure ci-dessus montre différents mécanismes qui permettent de dégrader les métabolites nocifs de la respiration cellulaires :
- Mécanismes enzymatiques : superoxyde dismutase (SOD), gluthadione peroxydase, catalase
- Mécanismes non enzymatiques : anti-oxydants (gluthadione, vitamines A et E), cuivre, fer.
Altération de la perméabilité membranaire
L’augmentation de la perméabilité de la membrane est un phénomène précoce commun à la majorité des agressions cellulaires. La membrane cellulaire peut aussi être directement attaquée par des toxines bactériennes, des virus et divers agents chimiques et physiques.
Les conséquences les plus importantes surviennent lors de l’atteinte de la membrane cellulaire elle-même, celle des mitochondries et des lysosomes.
L’altération de la membrane cellulaire peut parfois résulter en une libération de substances normalement contenues dans le cytoplasme des cellules. Ces substances peuvent ensuite diffuser dans le sang et être dosées et ainsi servir au diagnostic d’une maladie ou son suivi :
- Enzymes des cellules hépatiques pour l’hépatite
- Enzymes cardiaques pour l’infarctus du myocarde.
Dommages à l’ADN et aux protéines
Les cellules sont équipées de mécanismes de réparation de l’ADN lorsque celui-ci est trop endommagé (entre autres, la protéine P53). Toutefois, si le dommage est trop sévère pour être corrigé, la cellule sera entraînée vers la mort cellulaire par un mécanisme appelé apoptose. Un tel dommage peut être causé par des médicaments ou produits toxiques, des radiations ou un stress oxydatif.
Ce même processus est initié lorsque des protéines ont un défaut de structure tridimensionnelle : mutations chromosomiques, radicaux libres.
Résumé des mécanismes responsables de dommages cellulaires
Diminution de la quantité d’ATP:
- Conséquences sur la pompe à sodium, la respiration anaérobie, la synthèse des protéines, la membrane cellulaire, certaines organelles et la condensation de la chromatine.
Dommages aux mitochondries :
- Conséquences : diminution de la production d’ATP et libération de facteurs pro-apoptotiques
Influx de Ca2+ et perte de l’homéostasie du Ca2+:
- Conséquences : activation enzymatique de l’ATPase, de la phospholipase, de la protéase, de l’endonucléase.
Accumulation de radicaux libres (stress oxydatif):
- Conséquences : peroxydation des lipides, oxydation des protéines, dommage à l’ADN
Altération de la perméabilité membranaire:
- Conséquences sur l’intégrité de la pompe à sodium et l’homéostasie du Ca2+
Dommages à l’ADN et aux protéines :
- Conséquences : déclenchement de l’apoptose
Changements morphologiques des dommages et de la mort cellulaire
Généralités
Selon la nature, la durée et la sévérité de l’agression, mais aussi le type, l’état et la résistance des cellules agressées, il est possible de passer le point de non-retour et de causer des dommages irréversibles, qui conduisent à la mort cellulaire.
Le point de non-retour : on ne connaît pas encore le mécanisme exact qui enclenche le point de non-retour mais on connaît deux phénomènes qui caractérisent l’irréversibilité :
- Incapacité de renverser le mauvais état de fonctionnement des mitochondries (phosphorylation oxydative et production d’ATP) malgré la correction de l’agression initiale.
- Développement d’une atteinte importante de l’intégrité des membranes cellulaires et des organelles (ex : mitochondries, lysosomes).
Morphologie des dommages cellulaires :
- Toutes les agressions cellulaires se manifestent d’abord aux niveaux moléculaire et biochimique.
- Il y a toujours un certain délai entre le moment de l’agression et les changements morphologiques observables, qu’ils soient réversibles ou irréversibles.
- Le délai est aussi fonction du type d’examen que l’on fait : microscopie électronique < microscopie conventionnelle < macroscopie (minutes à quelques heures). Selon la technique d’observation utilisée, les dommages cellulaires seront visibles plus ou moins rapidement : s’observent d’abord les changements de l’ultrastructure, puis des dommages microscopiques légers et, finalement, des changements morphologiques.
Changements morphologiques réversibles
En microscopie optique, deux grands changements morphologiques réversibles témoignent d’une agression cellulaire : l’œdème cellulaire et la stéatose :
- L’œdème cellulaire (dégénérescence hydropique ou vacuolaire) survient lorsque la cellule est incapable de maintenir son équilibre ionique. Il est parfois difficile à voir en microscopie optique. Il se voit mieux en macroscopie (organe plus lourd et suintant à la coupe) et, surtout, en microscopie électronique.
- Stéatose (accumulation de lipides intracellulaires) : survient surtout dans les cellules impliquées dans le métabolisme des lipides (hépatocytes et cellules myocardiques).
Œdème intracellulaire / dégénérescence hydropique
Altération de la membrane cellulaire : formation de bulles, distorsion des microvillosités et désagrégation des jonctions intercellulaires.
Altérations des mitochondries : œdème
Dilatation du réticulum endoplasmique
Altérations nucléaires : désagrégation du nucléoplasme à condensation de la chromatine
Macroscopiquement, le tissu atteint est plus gros et d’aspect œdémateux.
Exemple des tubules rénaux chez un patient ayant souffert d’ischémie rénale suite à une hémorragie digestive massive : les cellules sont plus pâles et plus volumineuses et on observe un peu de condensation nucléaire.
Exemple d’une observation de dommages réversibles au niveau de l’intestin : disparition et internalisation des microvillosités ; formation de bulles cytoplasmiques.
Stéatose
La stéatose est l'accumulation de lipides à l'intérieur d'une cellule. C'est un phénomène que l'on observe plus fréquemment dans les hépatocytes et les cellules myocardiques.
Nécrose
Définition
La nécrose est le spectre des changements morphologiques qui suivent la mort cellulaire dans un tissu vivant résultant largement de la dénaturation des protéines et de la digestion enzymatique des constituants cellulaires.
Changements morphologiques irréversibles de la nécrose en microscopie optique
Hyperéosinophilie : réfère à une coloration plus rosée de la cellule en coloration hématoxyline et éosine due à une perte de ribosomes (ARN) et une dénaturation des protéines.
- L’hématoxyline est un colorant basique donc qui colore les substances acides (ADN, ARN). Le noyau apparaît donc bleu foncé.
- L’éosine est une substance acide qui se lie aux produits basiques, qu’on retrouve principalement dans le cytoplasme des cellules. Le cytoplasme de la cellule apparaît donc rose.
- Durant la nécrose, étant donné la dénaturation des protéines et la perte de l’ARN cytoplasmique, ce dernier paraît beaucoup plus rose qu’en temps normal.
Changements nucléaires :
- Une cellule nécrosée peut présenter un noyau petit et foncé (noyau condensé) : on parle de pycnose.
- Une cellule nécrosée peut présenter un noyau fragmenté : on parle de karyorrhexie
- Une cellule nécrosée peut ne pas présenter de noyau (celui-ci est complètement dissous et nous avons uniquement un fantôme cellulaire sans noyau) : on parle de karyolyse.
La dégradation des constituants se fait par les enzymes des lysosomes maintenant libérées dans le cytoplasme et par des cellules inflammatoires arrivées au site de la nécrose. Les cellules nécrosées présentent toutes une hyperéosinophilie. Dans certaines zones, on observe des noyaux condensés (pycnose) ; dans d’autres, les cellules ne présentent plus de noyaux (karyolyse). Les cellules inflammatoires abondent également 24 heures après l’infarctus.
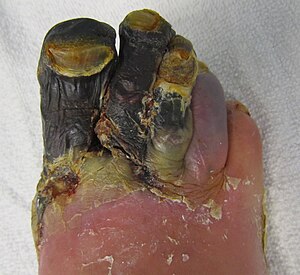
Exemple de la nécrose qui survient lors de l’infarctus du myocarde : les cellules cardiaques nécrosées libèrent localement des lipides, ce qui se traduit par une coloration jaunâtre.
Types de nécroses
Il existe différents types morphologiques de nécroses. Il est important de savoir les reconnaître car ils peuvent nous donner une indication sur la cause sous-jacente.
Nécrose de coagulation
Préservation temporaire de la forme des cellules (donc survient avant tout pour cellules qui contiennent peu de lysosomes). La dégradation cellulaire éventuelle sera accomplie par les enzymes des cellules inflammatoires. La cause la plus fréquente est l’anoxie due à une occlusion artérielle (infarctus). Lorsqu’elle s’applique à un membre, on parle de gangrène.
Nécrose de liquéfaction

Le tissu a un aspect semi-liquide en raison d'une digestion enzymatique importante. C'est un type de nécrose que l'on observe surtout dans les cas d'infections, en général bactériennes, puisque celles-ci entraînent une réaction inflammatoire intense. Le tissu cérébral démontre également une nécrose de liquéfaction.
Nécrose caséeuse
C'est une forme de nécrose de coagulation qui est principalement associée à une réaction inflammatoire de type granulomateuse. Elle est souvent causée par les infections myobactérienne, telle que la tuberculose. On peut reconnaître macroscopiquement la nécrose caséeuse par son aspect crémeux.
Nécrose hémorragique
C'est également une nécrose de coagulation qui se produit lors de l'occlusion du retour veineux d'un organe (à différencier d'une occlusion artérielle). Les vaisseaux en amont gonflent en amont de l'obstruction et la pression augmente dans les tissus. Il se produit alors une hémorragie, une extravasation du sang dans les tissus. Par exemple, une nécrose hémorragique apparaîtra suite à la torsion d'un organe qui obstrue le système veineux.
Nécrose graisseuse (cytostéatonécrose)
Elle se produit dans le tissu adipeux suite à sa digestion par des lipases. On la reconnaît par son aspect crayeux (semblable à de la craie). On peut parfois y observer des dépôts de calcium. (Triglycérides + lipase →acides gras libres + ions calcium.) Le diagnostic se fait lorsque l'on détecte une augmentation de l'amylasémie et de la lipasémie, c'est-à-dire le taux d'amylase et de lipase sanguin. Par exemple, lors du blocage du canal biliaire, les enzymes digestives pancréatiques telle que la lipase pancréatique restent dans le pancréas et le digère, causant une pancréatite.
Nécrose fibrinoïde
Elle ressemble à de la fibrine. On observe ce type de nécrose dans la paroi des vaisseaux où il y a localement un dépôt de protéines. Cette nécrose, surtout lorsqu'elle atteint l'endothélium, entraîne une thrombose du vaisseau, causant de l'anoxie dans les tissus autour. Elle peut même mener jusqu'à l'ischémie et la nécrose de ces tissus. On voit surtout la nécrose fibrinoïde dans les cas de vasculites (inflammation des vaisseaux) causées par des maladies auto-immunes ou d'hypersensibilité de type III.

Athérosclérose coronarienne : une cause fréquente d'ischémie et de nécrose du myocarde
Angine stable
Des plaques d'athérosclérose se forment et se fixent dans les artères coronaires. Elles peuvent se calcifier et s'ulcérer. Ces plaques réduisent le diamètre de vaisseaux, et empêche donc au myocarde d'avoir un apport suffisant en oxygène pour répondre à ses besoins. Cette baisse de production d'ATP suite à l'anoxie causée par la plaque d'athérosclérose engendre des dommages réversibles aux cellules myocardiques. Aucun changement morphologique notable sera observé au niveau macroscopique ou microscopique.
Effort → Ischémie du myocarde → Dommage réversible
Angine instable et l'infarctus du myocarde
Le détachement de la plaque athéromateuse formera un thrombus qui causera l'obstruction totale d'une artère coronaire. Ceci entraîne des dommages irréversibles aux cellules myocardiques, contrairement à l'angine stable. Au bilan sanguin, on observe une augmentation des enzymes cardiaques, les troponines.
Effort → Thrombus → Ischémie notable et prolongée → Nécrose tissulaire → Dommage irréversibles aux cellules myocardiques
Apoptose
L'apoptose est une voie de mort cellulaire induite par un programme génétique très régulé. La cellule destinée à mourir va activer des enzymes dans le but de dégrader son ADN, ses protéines nucléaires et cytoplasmiques. La membrane cellulaire reste intacte au cours de ce processus afin d'éviter toute réaction inflammatoire dans le tissu environnant. L'apoptose est un mécanisme d'involution qui mène à une baisse du nombre de cellules.
Apoptose en situation physiologique
Le processus aura lieu afin de se débarrasser de cellules inutiles ou potentiellement dangereuses, par exemple celles porteuses de d'altérations génétiques.
- Mécanisme d'adaptation ou en embryogénèse. Chez l'embryon, les doigts sont palmés (possèdent une membrane inter-digitales) et l'intestin est un tube plein. Ces cellules doivent être détruites au cours de la vie intra-utérine.
- Involution physiologique hormono-dépendante. Par exemple lors de la ménopause, il y a une atrophie physiologique de l'endomètre due à une baisse d'hormones sexuelles.
- Déplétion cellulaire au niveau du tissu épithélial prolifératif. Par exemple, des cellules intestinales sont constamment éliminées, alors que notre corps en refait de nouvelles.
- Mort des cellules hôtes (les cellules de notre propre corps) qui ont joué leur rôle dans une réaction inflammatoire et immune.
- Élimination des lymphocytes auto-réactifs. C'est ce que l'on appelle le phénomène de tolérance immunitaire.
- Mort cellulaire induite par les lymphocytes T cytotoxiques.
Apoptose en situation pathologique
- Mort cellulaire induite par des agents agresseurs touchant l'intégrité des mitochondries. Ex.: l'anoxie, la chaleur, les radiations, la médication anti-néoplasique, etc.
- Les infections virales, telles que le virus de l'hépatite C, entraîne la mort cellulaire.
- Atrophie pathologique de certains organes suite à l'obstruction des canaux excréteurs (par exemple le pancréas)
- Mort des cellules tumorales en régression ou en prolifération
Changements morphologiques caractéristiques de l'apoptose
- Condensation de la cellule : la cellule contient le même nombre d'organelles, mais ils sont plus entassés.
- Condensation du matériel génétique en chromatine
- Formation de bulles cytoplasmiques et de corps apoptiques. Les corps apoptiques résultent de la fragmentation de la cellule.
- Phagocytose des corps apoptiques par les macrophages.
Mécanismes de l'apoptose
Phase d'initiation
Cette phase mène à l'activation des caspases, enzymes responsables de l'apoptose, et peut se faire par voie extrinsèque ou intrinsèque.
Par voie extrinsèque (via des récepteurs)
Les cellules possèdent des récepteurs membranaires pouvant se lier aux molécules de la famille des TNF (Tumor Necrosis Factor). Lorsque le récepteur se lie avec un TNF, le domaine intracellulaire du récepteur est stimulé et ira se lier à la pro-caspase (qui est une caspase inactive) afin de l'activer en caspase.
Par voie intrinsèque (via les mitochondries)
Cette voie résulte de l'augmentation de la perméabilité de la paroi des mitochondries avec une libération de facteurs pro-apoptiques (Ex.: Cytochrome C). La paroi des mitochondries et le cytoplasme contiennt des protéines anti-apoptiques (Ex.: Bcl-2) ainsi que des protéines pro-apoptiques (Ex.: Bax/Bad) qui se retrouvent normalement à l'équilibre. Selon les signaux reçus par la cellule, il y aura une prédominance de protéines anti-apoptiques ou pro-apoptiques.
Trois systèmes peuvent produire un signal d'induction de l'apoptose.
- Voie de dommage aux mitochondries avec activation des caspases. (Causée par l'anoxie, les radicaux libres ou influx de calcium)
- Voie du dommage à l'ADN/ p53-p73. Un dommage à l'ADN résulte en une accumulation de la protéine p53; protéine qui induit normalement un processus de réparation de l'ADN. Si l'ADN ne peut pas être réparée, la protéine p53 activera la mort cellulaire par apoptose. C'est ce phénomène que l'on observe lorsqu'une cellule reçoit de l'irradiation ou de la chimiothérapie.
- Voie du dommage à la membrane cellulaire. Le dommage causé par la sphyngomyélinase, qui fait partie de la famille des ADNases, entraînera la formation de céramides qui mènera ultimement à l'apoptose de la cellule. Cette voie est empruntée lors d'exposition aux irradiations ou lorsqu'il y a accumulation de radicaux libres.
Lorsque la mitochondrie reçoit beaucoup de protéines Bax/Bad, elle sécrètent des facteurs apoptiques tels que le cytochrome C et l'AIF (Apoptosis Inducing Factor), qui causeront l'activation des caspases. Les protéines anti-apoptiques, quant à elle, inhibent les « signaux de mort cellulaire ». D'ailleurs, certaines cellules cancéreuses produisent beaucoup de Bcl-2, ce qui empêche leur apoptose.
Phase d'exécution
Lors de cette phase, les caspases déjà activées exercent leurs actions afin d'entraîner la mort cellulaire.
L'activation de la pro-caspase déclenche la cascade des caspases initiatrices (caspases 8 et 9) qui à leur tour activeront les caspases exécutrices. Les caspases exécutrices agissent sur le cytosquelette de la cellule (en hydrolysant les protéines cellulaires telles que celles contenues dans le cytosquelette et le gel nucléaire) ainsi que sur son ADN (en activant l'ADNase).
La cellule en apoptose exprime des phospholipides à la surface de sa membrane plasmique qui se retrouvent normalement à l'intérieur du cytoplasme. Ces phospholipides pourront être reconnus par les récepteurs des phagocytes afin de se débarrasser des corps apoptiques.
Accumulation intracellulaire anormale de substances
Mécanismes
- Exportation inadéquate d'une substance normale. Ceci est dû à une anomalie des mécanismes de transport de la substance. Par exemple, dans la stéatose hépatique (lorsqu'il y a accumulation de graisse dans les cellules du foie)
- Accumulation d'une substance endogène anormale. Cette accumulation est causée par une anomalie génétique ou acquise touchant les mécanismes de configuration structurale d'une protéine, de son enrobement, de son transport et/ou de sa sécrétion. Cette protéine est donc produite par le corps, mais l'un de ces mécanismes sont anormaux.
- Dégradation impossible d'un métabolite en raison d'une déficience enzymatique. Par exemple dans les maladies de storage.
- Accumulation d'une substance exogène anormale. Puisque la substance est exogène, la cellule ne possède pas les enzymes nécessaires à sa dégradation ou son exportation. C'est le cas de l'anthracose (pneumoconiose due à l'inhalation de charbon) et de la silicose (maladie pulmonaire causée par l'inhalation de poussière de silice).
Différents substrats pouvant s'accumuler dans une cellule
Ces substrats se divisent en trois catégories:
- Les constituants cellulaires normaux : lipides, protéines, hydrates de carbones.
- Les substances anormales exogènes (les minéraux d'un agent infectieux) ou endogènes (dont la synthèse est anormale).
- Les pigments exogènes (le charbon) ou endogènes (hémosidérine menant en une accumulation de fer).
1) Les lipides
Une accumulation de triglycérides mènent à la stéatose. Voici les principales causes et mécanismes d'accumulation de triglycérides :
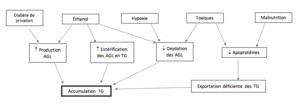
Les lipides peuvent aussi s'accumuler à l'intérieur de la cellule sous forme de cholestérol et/ou d'esters de cholestérol. C'est notamment ce que l'on observe lors de la formation de plaques d'athérosclérose. Un autre exemple est le xanthelasma, ou xanthome; un dépôt jaunâtre de cholestérol sous la peau. Ce signe visible à l'oeil nu est dû à un état d'hypertriglycéridémie et d'hypercholestorémie.
2) Les protéines
Par exemple, dans l'hépatite alcoolique, il y a accumulation de corps de Mallory qui sont des microfilaments.
3) Le glycogène
On observe une accumulation de glycogène intracellulaire dans les maladies de storage du glycogène, qui sont toutefois plutôt rares.
4) Les pigments
Il existe plusieurs pigments, en voici quelques exemples :
- Le charbon qui s'accumule dans les poumons des fumeurs ou des personnes vivant dans les grandes villes polluées.
- La lipofuscine, un pigment insoluble brun, s'emmagasine dans les cellules en voie de dégénérescence, suite à l'autophagie (atrophie) ou à l'âge.
- L'hémosidérine qui consiste en une accumulation de fer dans les globules rouges.
Accumulation de calcium : la calcification
Une calcification est causée par un dépôt anormal de sels. Dans la calcification dystrophique, le métabolisme du calcium ainsi que la calcémie (taux sérique de Calcium) sont normaux. C'est ce type de calcification que l'on retrouve dans les tissus en nécrose. La calcification métastatique a lieu, quant à elle, dans un tissu normal, et on l'observe dans les cas d'hypercalcémie.
Vieillissement
Le vieillissement est un facteur important dans le développement de nombreuses maladies telles que les maladies chroniques, les maladies cardiovasculaires, l'alzheimer et le cancer. Le vieillissement est un processus contrôlé par des gènes qui s'explique par le déclin des fonctions cellulaires et de leur viabilité, et serait causé par une exposition continue à des agents dommageables.
Mécanismes responsables du vieillissement
Dommage à l'ADN
Lorsque les mécanismes de réparation de l'ADN font défaut ou qu'ils sont insuffisants pour compenser les multiples agressions auxquelles sont soumis les gènes, certains dommages génétiques persistent. Ceux-ci ont un impact sur le fonctionnement cellulaire qui déclinera.
Diminution de la reproduction cellulaire
Les cellules possèdent une capacité limite de reproduction, c'est-à-dire un nombre maximal de divisions cellulaires possibles. On utilise le terme sénescence de reproduction pour illustré l'état terminal d'une cellule qui se retrouve sans capacité de reproduction.
Les télomères, se trouvant aux extrémités des chromosomes, protègent le matériel génétique. À chaque reproduction cellulaire somatique, il y a un rétrécissement des télomères puisqu'une partie de ceux-ci ne seront pas recopiés lors de la mitose. Éventuellement, ce rétrécissement des chromosomes sera perçu comme un dommage à l'ADN, et le cycle cellulaire de cette cellule arrêtera. La cellule finira par mourir d'elle-même ou d'une affection quelconque.
La télomérase est une enzyme qui régénère les télomères et qui empêche ainsi le raccourcissement des chromosomes. Toutefois, cette enzyme est souvent absente dans les cellules somatiques. On la retrouve davantage dans les cellules souches et germinales.
De plus, il existe des gènes appelés gènes suppresseurs de tumeur qui activés lors du vieillissement. C'est un processus normal. Ces gènes produisent des protéines capables de contrôler le passage de la phase G1 du cycle cellulaire à la phase S.
Défectuosité des l'homéostasie protéique
Avec le temps, il y a une diminution de la capacité des cellules à produire des protéines, et une diminution des activités chaperonnes qui assurent la structure tridimensionnelle idéale au bon fonctionnement protéique. On observe également avec l'âge une diminution de l'activité des protéases (enzymes responsables de la dégradation des protéines présentant une anomalie quelconque). Tous ces mécanismes cumulent en une accumulation de protéines intracellulaires qui mènera ultimement à l'apoptose des cellules concernées.
Dérangement de la sensibilité aux nutriments
Il a été noté qu'une restriction calorique ferait augmenter la longévité. La détection des nutriments est un processus qui contre le vieillissement cellulaire par de nombreux mécanismes :
- Ceci permett d'augmenter la capacité de réparation de l'ADN ;
- Aide au maintien de l'homéostasie des protéines ;
- Diminue l'apoptose ;
- Réduit les effets des radicaux libres.
