ULaval:Médecine/Intégration/Embolie pulmonaire
L'embolie pulmonaire (EP) consiste en une obstruction mécanique endovasculaire de la vascularisation pulmonaire. [1]
IN1-131 Nommer les facteurs de risque et causes de la maladie thromboembolique veineuse.
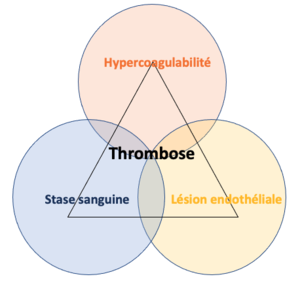
L'EP est d'origine multifactorielle. Aucun facteur déclencheur n'est identifié dans le tiers des cas de thrombo-embolies veineuses (TEV) [1][2][3]. Les embolies pulmonaires proviennent majoritairement des TVP (80 %) des membres inférieurs, mais divers éléments passant dans la circulation pulmonaire, tels que l'air, la graisse ou les cellules tumorales, peuvent aussi être en cause[4][1]. Les facteurs de risque clés de la thrombose peuvent se regrouper sous trois principales catégories (triade de Virchow) [1]:
- La stase sanguine : les conditions empêchant le retour veineux comme l'alitement prolongé et l'immobilisation.
- Les lésions endothéliales : les atteintes causant une dysfonction ou des dommages à l'endothélium vasculaire comme dans le contexte de sepsis, d'utilisation de cathéter veineux central, de trauma ou de chirurgie.
- L'hypercoagulabilité : les désordres de la coagulation, incluant les thrombophilies héréditaires, la grossesse, la prise d'œstrogènes ou un cancer actif.
Dans le cas des TEV, les facteurs les plus importants sont en lien avec la stase sanguine ainsi que l'augmentation de la coagulation [5].
Les sites les plus communs de TVP sont les veines des membres inférieurs, (iliaques, fémorales, poplitées), particulièrement au niveau des bifurcations ou des cuspides valvulaires étant donné la stase sanguine à ces endroits. D'autres sites de TVP sont également possibles dont les veines pelviennes et rénales, la veine cave inférieure ou encore les veines situées dans les membres supérieurs [6][7][8][9].
| Catégorie | Facteurs de risque | |
|---|---|---|
| Acquis | Hypercoagulabilité |
|
| Dommage vasculaire |
| |
| Stase veineuse |
| |
| Héréditaires | ||
Les facteurs de risque les plus importants sont identifiés par un (+). À retenir que la classification proposée selon la triade de Virchow demeure imparfaite : certains facteurs de risque (par exemple un trauma, une néoplasie, etc.) peuvent atteindre plusieurs composantes de la triade.
Finalement, un antécédent personnel ou familial (+) de thrombo-embolie veineuse est aussi un facteur de risque clé. Il ne faut pas oublier qu'environ 30 % des EP ne sont pas provoquées, c'est-à-dire qu'aucun facteur de risque n'est identifié. [2]
IN1-132 Expliquer l'utilité du score clinique de Wells et les critères utilisés.
L'inclusion depuis Embolie pulmonaire est brisée car la zone ou section visée n'existe pas.L'inclusion depuis Embolie pulmonaire est brisée car la zone ou section visée n'existe pas.
IN1-133 Reconnaitre la présentation clinique de l'embolie pulmonaire.
L'inclusion depuis Embolie pulmonaire est brisée car la zone ou section visée n'existe pas.
IN1-134 Prescrire et interpréter l'investigation pertinente de l'embolie pulmonaire.
L'inclusion depuis Embolie pulmonaire est brisée car la zone ou section visée n'existe pas.Le diagnostic d'une EP est établi à l'aide de la présentation clinique, des règles de décision cliniques, ainsi que des examens paracliniques individualisés au contexte du patient. Il est confirmé par l'imagerie.
L'inclusion depuis Embolie pulmonaire est brisée car la zone ou section visée n'existe pas.
IN1-135 Expliquer le rôle et les limitations des D-Dimères pour le diagnostic d'une embolie pulmonaire.
L'inclusion depuis Embolie pulmonaire est brisée car la zone ou section visée n'existe pas.
IN1-136 Expliquer brièvement les différentes mesures thérapeutiques disponibles pour le traitement de l'embolie pulmonaire.
Le traitement de l'EP comporte quatre volets :
- le traitement de support
- les stratégies de reperfusion
- l'anticoagulothérapie
- le traitement de maintien et de suivi.
Celui-ci sera stratifié en fonction de l'impact hémodynamique de l'EP et en fonction de la suspicion d'EP chez un patient individuel. Les patients sont classés en suspicion d'EP faible, intermédiaire ou élevée sur la base du score Wells.
La décision d'hospitalisation repose sur les facteurs de mauvais pronostic présents (ou absents) chez le patient. Le score PESI permet de supporter le choix de l'orientation du patient : traitement ambulatoire ou hospitalisation.
Traitement de support
| Traitement de support | Explications |
|---|---|
| Hypoxémie |
|
| Hypotension |
|
| Analgésie |
|
| Trajectoire de soins |
|
Stratégies de reperfusion
Chez les patients avec une suspicion clinique élevée d'EP qui sont hémodynamiquement instables (signes vitaux affectés ou fonction du VD compromise) ou qui se détériorent cliniquement, la thrombolyse doit être considérée. Bien que controversées, l'embolectomie pulmonaire chirurgicale ou la thérapie dirigée par cathéter sont des options de reperfusion possibles chez des patients ciblés, dont ceux présentant des contre-indications à la thrombolyse.[1][15]
| Stratégie de reperfusion | Explications | ||||
|---|---|---|---|---|---|
| Thrombolyse |
| ||||
| Traitement dirigé par cathéter |
| ||||
| Embolectomie chirurgicale |
Anticoagulation
L'anticoagulation est le pilier du traitement de l'embolie pulmonaire. Chez ceux pour qui l'anticoagulation est contre-indiquée, l'installation percutanée d'un filtre dans la veine cave inférieure peut être envisagée une fois le diagnostic d'EP confirmé. Le traitement de l'EP se fait en deux phases, l'anticoagulation initiale et celle de maintien.
Anticoagulation initiale
| Hémodynamie | Suspicion | Description |
|---|---|---|
| Stable | Forte | Anticoagulation dès que possible |
| Moyenne | Attendre imagerie avant anticoagulation si peut être réalisée < 4 heures | |
| Faible | Attendre imagerie avant anticoagulation si peut être réalisée < 24 heures | |
| Instable et suspicion élevée | Traitement anticoagulant après thrombolyse[15] | |
Plusieurs choix d'anticoagulants sont possibles. Les lignes directrices favorisent généralement les anticoagulants oraux directs (inhibiteurs du facteur Xa PO) aux ponts à l'héparine avec la warfarine en traitement de maintien.
En règle général, l'héparine (peu importe sa forme) est préférée chez les patients à risque intermédiaire élevé et à haut risque (classification de l'ESC), puisqu'elle nous offre la possibilité de procéder à la thrombolyse plus rapidement advenant une détérioration clinique du patient.
L'héparine de bas poids moléculaire (HBPM), le fondaparinux et les inhibiteurs du facteur Xa sont préférés car :
- Ils ont une incidence moindre d'induction de saignements majeurs et de thrombocytopénie induite par l'héparine.
- Ils ont un profil d'utilisation prédictible et sécuritaire.
Toutefois, l'héparine non fractionnée (HNF) est à privilégier chez certains patients :
- Patient comportant un risque hémostatique élevé.
- Patient en post-thrombolyse, étant donné la possibilité de renverser rapidement l'action de HNF.
- Patient ayant une insuffisance rénale stade 3b-4 (DFG < 15-30 ml/min).
En effet, l'HPNF est préférée dans ces contextes en raison de sa faible demi-vie et de l'efficacité de l'antidote (protamine). En revanche, elle demande une hospitalisation et un suivi serré car son profil pharmacologique est difficilement prédictible.[26]
| Anticoagulant | Posologie |
|---|---|
| Héparine IV non fractionnée (HPNF) |
|
| Héparine de bas poids moléculaire SC (HBPM) |
|
| Inhibiteur du facteur Xa |
|
| Inhibiteur direct de la thrombine |
|
Anticoagulant de maintien
Le but de l'anticoagulation après la prise en charge aiguë de la PE est de compléter le traitement de l'épisode aigu et également de prévenir la récidive de la TEV sur le long terme.[1]
| Classe de médicament | Médicament | Commentaires |
|---|---|---|
| Anticoagulants oraux directs[28] |
|
|
| Antagoniste de la vitamine K PO | Warfarine à ajuster pour INR entre 2 et 3 | La warfarine demeure le premier choix chez certains patients [2][28]:
Chez la plupart des patients, son administration commencera en même temps que la thérapie initiale (souvent HBPM), car il faut compter un délai d'au moins cinq jours avant d'atteindre la fenêtre thérapeutique, c'est-à-dire un INR de 2 à 3 pendant deux jours consécutifs. Cependant, l'INR doit être dosé périodiquement afin d'empêcher l'anticoagulation excessive. |
| Héparine de bas poids moléculaire SC[note 5] |
|
|
Durée d'anticoagulation de maintien
La durée de l'anticoagulothérapie dépend principalement du contexte de l'embolie pulmonaire (provoquée vs non provoquée). Toute embolie pulmonaire doit être traitée au moins 3 mois, à moins de risques de saignement[note 4] surpassant les bénéfices.
Une embolie pulmonaire est considérée provoquée s'il y a eu :
- un trauma
- une chirurgie avec anesthésie générale d'une durée > 30 minutes
- une immbolisation dans un contexte aigu pour au moins 3 jours (typiquement hospitalisation d'au moins 3 jours)
- ou en fonction du jugement clinique.
Dans un tel contexte, advenant le 1er épisode, la durée d'anticoagulothérapie est de 3 mois inclusivement. Advenant des épisodes subséquents, la conduite demeure la même.
En présence d'un facteur de risque persistant (non-transitoire) ayant contribué de façon significative à l'embolie pulmonaire (alors dite provoquée), l'anticoagulothérapie doit être continuée jusqu'à la résolution du facteurs de risque en question. Cela inclut typiquement les néoplasies et les cathéters veineux.
Si l'embolie pulmonaire est dite non-provoquée, la pratique actuelle est d'anticoaguler pour un minimum de 3 mois et de ré-évaluer par la suite. Advenant plusieurs évènements thrombo-emboliques, la norme actuelle est d'anticoaguler à vie à moins d'un risque de saignement[note 4] dépassant les bénéfices de l'anticoagulation.
Le score HERDOO2 permet d'identifier, chez les femmes, un faible risque de récurrence de thromboembolie veineuse après un premier événement non-provoqué. Chez les femmes avec un score < 2, l'anticoagulation peut être cessée après 3 mois. L'anticoagulation devrait être poursuivie à plus long terme chez les femmes avec un score ≥ 2.[32]
| Facteur de risque | Points |
|---|---|
| Hyperpigmentation d'une jambe | 1 |
| Oedeme (Edema) d'une jambe | 1 |
| Rougeur d'une jambe | 1 |
| D-dimère ≥ 250 mcg/L | 1 |
| Obésité (IMC ≥ 30) | 1 |
| Âge (Older age) ≥ 65 ans | 1 |
| Score ≥ 2 = haut risque de récurence de thromboembolie si arrêt de l'anticoagulation. | |
Filtres de la veine cave inférieure
Ceux-ci bloquent le trajet des emboles en provenance de la circulation veineuse des membres inférieurs, empêchant ainsi l'atteinte de la vascularisation pulmonaire. Les indications sont :
- une contre-indication absolue aux anticoagulants
- une TEV récidivante malgré une anticoagulothérapie optimale.
Dès que possible, l'anticoagulothérapie doit être reprise et le filtre de la veine cave inférieur pourra éventuellement être retiré.
En effet, l'étude PREPIC (Prevention of Recurrent Pulmonary Embolism by Vena Cava Interruption) a montré que l'insertion d'un filtre permanent de la veine cave était associée à une réduction significative du risque de récidive d'EP et à une augmentation substantielle du risque de TVP, sans différence notable dans le risque de TEV récidivante ou de décès. [33][1][2]
Embolies sous-segmentaires
Les embolies sous-segmentaires font l'objet d'une controverse. En général, la présence d'au moins 2 embolies sous-segmentaires peuvent justifier, en absence de risque augmenté de saignement[note 4], une anticoagulothérapie telle que déjà discutée. Toutefois, en la présence d'une seule embolie pulmonaire sous-segmentaire et en l'absence d'une thrombose veineuse profonde, l'anticoagulothérapie n'est généralement pas de mise, sauf en présence d'un contexte prothrombotique concomitant tel que les néoplasies. [34][2][35][36][37]
IN1-137 Décrire les principales complications de l'embolie pulmonaire.
Les complications majeures de l'EP peuvent être aiguës ou chroniques et elles comprennent [1]:
- le coeur pulmonaire aigu menant au choc cardiogénique et à la mort
- des récidives d'embolie pulmonaire à envisager s'il y a récurrence ou détérioration des symptômes[note 6]
- l'AVC[note 7][38] si embolies paradoxales par le passage au niveau d'un foramen oval patent
- le flutter auriculaire (chronique) et la fibrillation auriculaire (chronique)
- l'hypertension pulmonaire thromboembolique chronique (5 %) (HPTEC)[note 8].
Pour tous les patients atteints de HPTEC, un traitement anticoagulant à vie est recommandé. En outre, une référence précoce pour évaluer la possibilité d'une thromboendartériectomie pulmonaire est fortement recommandée. [1]
Notes
- ↑ Via un dommage de l'endothélium vasculaire
- ↑ Notons que plusieurs régimes existent dans la littérature, mais celui-ci est le plus simple.
- ↑ La dose de fondaparinux est de 50 % si la clairance de la créatinine est entre 30-50 ml/min; en dessous de 30 ml/min, elle est contre-indiquée.
- ↑ 4,0 4,1 4,2 et 4,3 Voici quelques facteurs de risque de saignement :
- âge > 65 ans
- antécédents de saignement
- thrombocytopénie
- thérapie anti-plaquettaire
- chutes fréquentes
- défaillance hépatique
- abus d'alcool
- chirurgie récente
- capacité fonctionnelle réduite
- antécédents d'AVC
- diabète
- anémie
- cancer
- insuffisance rénale
- ↑ Pour les patients à haut-risque souffrant de néoplasie ou ceux avec des EPs chroniques malgré l'usage d'autres anti-coagulants.
- ↑ Surtout une à deux semaines suivant le diagnostic initial. Une anticoagulation inadéquate est la raison la plus courante de récidive de la thromboembolie veineuse pendant le traitement.
- ↑ Il y aurait un risque accru d'accident vasculaire cérébral, que l'on pense être associé à une embolie paradoxale via un foramen ovale perméable (PFO) chez les patients atteints de EP aiguë.
- ↑ Se manifeste par la présence de dyspnée persistante ou progressive surtout dans les 3 mois à 2 ans suivant le diagnostic. Devrait être suivie avec un angio-TDM pulmonaire, une scintigraphie V/Q et une échocardiographie. Le diagnostic d'hypertension pulmonaire est confirmé par un cathétérisme cardiaque droit et une angiographie pulmonaire. Ces examens servent aussi à quantifier le degré d'hypertension pulmonaire, exclure les diagnostics concurrents, définir l'accessibilité chirurgicale des lésions thrombotiques obstructives, confirmer qu'une composante acceptable de la résistance vasculaire pulmonaire élevée est due à une maladie chirurgicalement accessible et non à une obstruction distale ou à une artériopathie secondaire.
Références
- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 1,11 1,12 1,13 1,14 et 1,15 Vrinda Vyas et Amandeep Goyal, StatPearls, StatPearls Publishing, (PMID 32809386, lire en ligne)
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 2,7 2,8 et 2,9 (en) Marcello Di Nisio, Nick van Es et Harry R Büller, « Deep vein thrombosis and pulmonary embolism », The Lancet, vol. 388, no 10063, , p. 3060–3073 (DOI 10.1016/S0140-6736(16)30514-1, lire en ligne)
- ↑ (en) C. Kearon, W. Ageno, S. C. Cannegieter et B. Cosmi, « Categorization of patients as having provoked or unprovoked venous thromboembolism: guidance from the SSC of ISTH », Journal of Thrombosis and Haemostasis, vol. 14, no 7, , p. 1480–1483 (ISSN 1538-7836, DOI 10.1111/jth.13336, lire en ligne)
- ↑ W. W. Coon et P. W. Willis, « Deep venous thrombosis and pulmonary embolism: prediction, prevention and treatment », The American Journal of Cardiology, vol. 4, , p. 611–621 (ISSN 0002-9149, PMID 13811755, DOI 10.1016/0002-9149(59)90145-6, lire en ligne)
- ↑ 5,0 et 5,1 (en) Allan Victor Hoffbrand, Hoffbrand's Essential Haematology, , pages 303 à 307
- ↑ R. L. Kistner, J. J. Ball, R. A. Nordyke et G. C. Freeman, « Incidence of pulmonary embolism in the course of thrombophlebitis of the lower extremities », American Journal of Surgery, vol. 124, no 2, , p. 169–176 (ISSN 0002-9610, PMID 5045886, DOI 10.1016/0002-9610(72)90009-8, lire en ligne)
- ↑ K. M. Moser et J. R. LeMoine, « Is embolic risk conditioned by location of deep venous thrombosis? », Annals of Internal Medicine, vol. 94, no 4 pt 1, , p. 439–444 (ISSN 0003-4819, PMID 7212500, DOI 10.7326/0003-4819-94-4-439, lire en ligne)
- ↑ E. E. Weinmann et E. W. Salzman, « Deep-vein thrombosis », The New England Journal of Medicine, vol. 331, no 24, , p. 1630–1641 (ISSN 0028-4793, PMID 7772110, DOI 10.1056/NEJM199412153312407, lire en ligne)
- ↑ Kirsten van Langevelde, Alexandr Srámek, Patrice W. J. Vincken et Jan-Kees van Rooden, « Finding the origin of pulmonary emboli with a total-body magnetic resonance direct thrombus imaging technique », Haematologica, vol. 98, no 2, , p. 309–315 (ISSN 1592-8721, PMID 22801962, Central PMCID 3561441, DOI 10.3324/haematol.2012.069195, lire en ligne)
- ↑ 10,0 10,1 et 10,2 (en) Robert Hillman, Hematology in Clinical Practice, , p. 428-431
- ↑ (en) G.E. Raskob, P. Angchaisuksiri, A.N. Blanco et H. Buller, « Thrombosis: A Major Contributor to Global Disease Burden », Arteriosclerosis, Thrombosis, and Vascular Biology, vol. 34, no 11, , p. 2363–2371 (ISSN 1079-5642 et 1524-4636, DOI 10.1161/ATVBAHA.114.304488, lire en ligne)
- ↑ Hilde Jensvoll, Marianne T. Severinsen, Jens Hammerstrøm et Sigrid K. Brækkan, « Existing data sources in clinical epidemiology: the Scandinavian Thrombosis and Cancer Cohort », Clinical Epidemiology, vol. 7, , p. 401–410 (ISSN 1179-1349, PMID 26396546, Central PMCID 4577261, DOI 10.2147/CLEP.S84279, lire en ligne)
- ↑ John A. Heit, « Epidemiology of venous thromboembolism », Nature Reviews. Cardiology, vol. 12, no 8, , p. 464–474 (ISSN 1759-5010, PMID 26076949, Central PMCID 4624298, DOI 10.1038/nrcardio.2015.83, lire en ligne)
- ↑ Erreur de référence : Balise
<ref>incorrecte : aucun texte n’a été fourni pour les références nommées:26 - ↑ 15,0 et 15,1 (en) « PULMONARY EMBOLISM: DIAGNOSIS AND MANAGEMENT », sur thrombosiscanada.ca, (consulté le 17 janvier 2021)
- ↑ S. Z. Goldhaber, W. D. Haire, M. L. Feldstein et M. Miller, « Alteplase versus heparin in acute pulmonary embolism: randomised trial assessing right-ventricular function and pulmonary perfusion », Lancet (London, England), vol. 341, no 8844, , p. 507–511 (ISSN 0140-6736, PMID 8094768, DOI 10.1016/0140-6736(93)90274-k, lire en ligne)
- ↑ S. Dalla-Volta, A. Palla, A. Santolicandro et C. Giuntini, « PAIMS 2: alteplase combined with heparin versus heparin in the treatment of acute pulmonary embolism. Plasminogen activator Italian multicenter study 2 », Journal of the American College of Cardiology, vol. 20, no 3, , p. 520–526 (ISSN 0735-1097, PMID 1512328, DOI 10.1016/0735-1097(92)90002-5, lire en ligne)
- ↑ L. B. Daniels, J. A. Parker, S. R. Patel et F. Grodstein, « Relation of duration of symptoms with response to thrombolytic therapy in pulmonary embolism », The American Journal of Cardiology, vol. 80, no 2, , p. 184–188 (ISSN 0002-9149, PMID 9230156, DOI 10.1016/s0002-9149(97)00315-9, lire en ligne)
- ↑ Christophe Marti, Gregor John, Stavros Konstantinides et Christophe Combescure, « Systemic thrombolytic therapy for acute pulmonary embolism: a systematic review and meta-analysis », European Heart Journal, vol. 36, no 10, , p. 605–614 (ISSN 1522-9645, PMID 24917641, Central PMCID 4352209, DOI 10.1093/eurheartj/ehu218, lire en ligne)
- ↑ (en) Jennifer E. Fugate et Alejandro A. Rabinstein, « Absolute and Relative Contraindications to IV rt-PA for Acute Ischemic Stroke: », The Neurohospitalist, (PMID 26288669, Central PMCID PMC4530420, DOI 10.1177/1941874415578532, lire en ligne)
- ↑ Alfonso J. Tafur, Fadi E. Shamoun, Salma I. Patel et Denisse Tafur, « Catheter-Directed Treatment of Pulmonary Embolism: A Systematic Review and Meta-Analysis of Modern Literature », Clinical and Applied Thrombosis/Hemostasis: Official Journal of the International Academy of Clinical and Applied Thrombosis/Hemostasis, vol. 23, no 7, , p. 821–829 (ISSN 1938-2723, PMID 27481877, DOI 10.1177/1076029616661414, lire en ligne)
- ↑
- ↑ Timothy Lee, Shinobu Itagaki, Yuting P. Chiang et Natalia N. Egorova, « Survival and recurrence after acute pulmonary embolism treated with pulmonary embolectomy or thrombolysis in New York State, 1999 to 2013 », The Journal of Thoracic and Cardiovascular Surgery, vol. 155, no 3, , p. 1084–1090.e12 (ISSN 1097-685X, PMID 28942971, DOI 10.1016/j.jtcvs.2017.07.074, lire en ligne)
- ↑ W. Brent Keeling, Thor Sundt, Marzia Leacche et Yutaka Okita, « Outcomes After Surgical Pulmonary Embolectomy for Acute Pulmonary Embolus: A Multi-Institutional Study », The Annals of Thoracic Surgery, vol. 102, no 5, , p. 1498–1502 (ISSN 1552-6259, PMID 27373187, DOI 10.1016/j.athoracsur.2016.05.004, lire en ligne)
- ↑ Chetan Pasrija, Anthony Kronfli, Michael Rouse et Maxwell Raithel, « Outcomes after surgical pulmonary embolectomy for acute submassive and massive pulmonary embolism: A single-center experience », The Journal of Thoracic and Cardiovascular Surgery, vol. 155, no 3, , p. 1095–1106.e2 (ISSN 1097-685X, PMID 29452460, DOI 10.1016/j.jtcvs.2017.10.139, lire en ligne)
- ↑ https://www.ncbi.nlm.nih.gov/pubmed/32809386
- ↑ (en) « Unfractionned heparin, low molecular weight heparin and fondaparinux », sur thrombosiscanada.ca, (consulté le 8 octobre 2021)
- ↑ 28,0 28,1 et 28,2 « Thrombose veineuse profonde et embolie pulmonaire chez l'adulte », sur Inesss.qc.ca, (consulté le 6 septembre 2021)
- ↑ (en) Giancarlo Agnelli, Harry R. Buller, Alexander Cohen et Madelyn Curto, « Apixaban for Extended Treatment of Venous Thromboembolism », New England Journal of Medicine, vol. 368, no 8, , p. 699–708 (ISSN 0028-4793 et 1533-4406, DOI 10.1056/NEJMoa1207541, lire en ligne)
- ↑ (en) Jeffrey I. Weitz, Anthonie W.A. Lensing, Martin H. Prins et Rupert Bauersachs, « Rivaroxaban or Aspirin for Extended Treatment of Venous Thromboembolism », New England Journal of Medicine, vol. 376, no 13, , p. 1211–1222 (ISSN 0028-4793 et 1533-4406, DOI 10.1056/NEJMoa1700518, lire en ligne)
- ↑ (en) Clive Kearon, Elie A. Akl, Joseph Ornelas et Allen Blaivas, « Antithrombotic Therapy for VTE Disease », Chest, vol. 149, no 2, , p. 315–352 (DOI 10.1016/j.chest.2015.11.026, lire en ligne)
- ↑ 32,0 et 32,1 (en) Marc A. Rodger, Gregoire Le Gal, David R. Anderson et Jeannot Schmidt, « Validating the HERDOO2 rule to guide treatment duration for women with unprovoked venous thrombosis: multinational prospective cohort management study », BMJ, vol. 356, , j1065 (ISSN 0959-8138 et 1756-1833, PMID 28314711, Central PMCID PMC6287588, DOI 10.1136/bmj.j1065, lire en ligne)
- ↑ PREPIC Study Group, « Eight-year follow-up of patients with permanent vena cava filters in the prevention of pulmonary embolism: the PREPIC (Prevention du Risque d'Embolie Pulmonaire par Interruption Cave) randomized study », Circulation, vol. 112, no 3, , p. 416–422 (ISSN 1524-4539, PMID 16009794, DOI 10.1161/CIRCULATIONAHA.104.512834, lire en ligne)
- ↑ Erreur de référence : Balise
<ref>incorrecte : aucun texte n’a été fourni pour les références nommées:11 - ↑ Hugo HB Yoo, Vania Santos Nunes-Nogueira et Paulo J Fortes Villas Boas, « Anticoagulant treatment for subsegmental pulmonary embolism », Cochrane Database of Systematic Reviews, (ISSN 1465-1858, PMID 32030721, Central PMCID PMC7004894, DOI 10.1002/14651858.cd010222.pub4, lire en ligne)
- ↑ (en) Hugo HB Yoo, Thais HAT Queluz et Regina El Dib, Cochrane Database of Systematic Reviews, John Wiley & Sons, Ltd, (DOI 10.1002/14651858.cd010222.pub2, lire en ligne), p. CD010222.pub2
- ↑ (en) J. Goy, J. Lee, O. Levine et S. Chaudhry, « Sub-segmental pulmonary embolism in three academic teaching hospitals: a review of management and outcomes », Journal of Thrombosis and Haemostasis, vol. 13, no 2, , p. 214–218 (DOI 10.1111/jth.12803, lire en ligne)
- ↑ Sylwia Goliszek, Małgorzata Wiśniewska, Katarzyna Kurnicka et Barbara Lichodziejewska, « Patent foramen ovale increases the risk of acute ischemic stroke in patients with acute pulmonary embolism leading to right ventricular dysfunction », Thrombosis Research, vol. 134, no 5, , p. 1052–1056 (ISSN 1879-2472, PMID 25282541, DOI 10.1016/j.thromres.2014.09.013, lire en ligne)

