Embolie pulmonaire
| Maladie | |
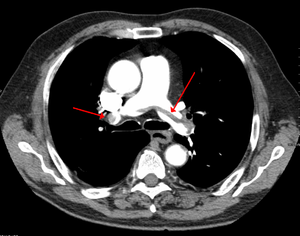 Embolie pulmonaire au TDM | |
| Caractéristiques | |
|---|---|
| Signes | Crépitants, Choc obstructif, Tension veineuse centrale augmentée, Tachycardie , Tachypnée , Hypoxémie (signe paraclinique), Thrombose veineuse profonde du membre inférieur, Murmure vésiculaire diminué, B2P augmenté, Hyperdynamie ventriculaire droite, ... [+] |
| Symptômes |
Dyspnée à l'effort, Dyspnée au repos, Dyspnée , Vertige , Syncope , Fatigue , Anxiété , Douleur thoracique , Toux , Douleur pleurétique , ... [+] |
| Diagnostic différentiel |
Pneumothorax, Crise d'anxiété avec hyperventilation, Insuffisance cardiaque, Syncope vasovagale, Syndrome coronarien aigu, Arythmies, Angine stable, Péricardite aiguë, Pneumonie, Exacerbation aiguë de la maladie pulmonaire obstructive chronique |
| Informations | |
| Terme anglais | Pulmonary embolism |
| Autres noms | Thromboembolie pulmonaire |
| Spécialités | Hématologie, Pneumologie |
|
| |
L'embolie pulmonaire (EP) consiste en une obstruction mécanique d'une ou de plusieurs artères pulmonaires par un caillot sanguin originant du système veineux et plus typiquement des grandes veines du bassin ou des jambes lors d'un thrombose veineuse profonde (TVP). L'EP est une condition critique qui met le pronostic vital du patient en jeu, elle devrait donc être diagnostiquée promptement. Le traitement de l'EP repose sur l'anticoagulation initiale afin d'empêcher la formation de nouveaux caillots et puis sur une anticoagulation de maintient le temps d'éliminer le facteur causal de l'EP.
Signes et symptômes
Les signes et les symptômes varient en fonction de la sévérité et de nombreux autres facteurs (comme la fonction cardiopulmonaire). Même lorsque présents, ils sont parfois peu spécifiques.
Signes
- Tachypnée
- Tachycardie
- Hypotension
- Signes de thrombose veineuse profonde
- Présyncope/syncope/arrêt cardiaque
Symptômes
- Dyspnée aiguë (peut être minimale au repos et pire lors d'activité)
- Douleur pleurétique
- Fièvre (faible)
- Toux
- Hémoptysies
- Délirium (gériatrie)
- Anxiété
Diagnostic et investigation
Le diagnostic de l'EP repose sur les trois principes suivants: L'indice de suspicion, la probabilité pré-test et les résultats de tests subséquents.
Investigation initiale
- ECG: permet d'exclure un infarctus et d'identifier certains critères suspects d'un EP, comme des anomalies du segment ST, des ondes P pulmonaires, une modification du complexe QRS (S1Q3T3) ou une déviation axiale droite.
- Gaz artériel: pour objectiver une hypoxémie avec une alcalose respiratoire.
- Radiographie du thorax: souvent normale, elle permettra d'éliminer d'autres pathologies pouvant expliquer les symptômes. Elle peut aussi montrer d'autres signes non spécifiques, comme une atelectasie, des infitrats focaux, un épanchement pleural ou un hémidiaphragme élevé.
- Évaluation de la probabilité clinique: la combinaison des tests d'investigation initiale avec les trouvailles de l'examen physique de le l'histoire orientent le diagnostic et les tests subséquents. À cet effet, le Score de Wells est particulièrement utile.[1]
| Critères | Points | Points (version simplifiée) |
Présent |
|---|---|---|---|
| Symptômes ou signes de thrombose veineuse profonde | 3 | 1 | |
| Autres diagnostics moins probables | 3 | 1 | |
| FC > 100/min | 1.5 | 1 | |
| Immobilisation (≥ 3 jours) ou chirurgie récente (< 4 semaines) | 1.5 | 1 | |
| Antécédents de thrombose veineuse profonde ou d'embolie pulmonaire | 1.5 | 1 | |
| Hémoptysies | 1 | 1 | |
| Cancer | 1 | 1 | |
| Probabilité | Faible | ||
| Probabilité (version simplifiée) | Peu probable | ||
- Version originale: faible (0-1), intermédiaire (2-6), Élevée (>6)[note 1]
- Version simplifiée: peu probable (0-1), plus probable (>1)[note 2]
Diagnostic
- Probabilité faible: un test aux D-dimères doit être fait. Un résultat négatif exclus une embolie pulmonaire, mais un résultat positif ne le confirme pas et nécessite une scintigraphie V/Q.
- Probabilité intermédiaire, élevée ou D-dimères positifs:
- Un angio-CT ou un scan V/Q (ventilation/perfusion) peuvent être obtenus.
- L'angioscan pulmonaire est le gold standard pour le diagnostic d'embolie pulmonaire.
- Dans les cas ou l'un et l'autre tests ne seraient pas disponibles ou contre-indiqués, un doppler veineux des membres inférieurs et/ou supérieurs à la recherche d'un thrombus (la veine ne sera pas compressible) peut augmenter la suspicion clinique et confimer le besoin de traiter un patient symptomatique. Cependant, un ultrason négatif ne permet pas d'exclure une EP.[1]
D'autres tests peuvent être exécutés, mais ces derniers n'ont pas vraiment de valeur diagnostiques.
- echocardiographie: afin d'objectiver un thrombus dans l'oreillette ou le ventricule droit.
- marqueurs cardiaques: signes de mauvais pronostic dans l'EP massive
- recherche de thrombophilies: spécialement si le patient a moins de 35 ans, fait des récidives d'EP ou possède un histoire familiale positive
Algorithme
Plusieurs algorithmes de traitement on été proposés, aucun n'est évidemment parfait. Le diagnostic et la décision de traiter ou non repose donc entièrement sur le jugement du clinicien.
Diagnostic différentiel
- Ischémie cardiaque
- Défaillance cardiaque
- Exacerbation de MPOC
- Pneumothorax
- Septicémie
- Crise d'anxiété avec hyperventilation
Traitement
Le traitement de l'EP se décline en quatre volets, le maintien des signes vitaux, l'anticoagulation et parfois la thrombolyse et/ou l'installation d'un filtre dans la veine cave inférieure. Une hospitalisation d'au moins 24-48h est de mise pour tous et ceux dont le pronostic vital est confirmé ou souffrant d'une EP massive devront être admis aux soins intensifs.
Maintient des signes vitaux
Une évaluation rapide du besoin de support devrait être entreprise afin de maintenir les signes vitaux du patient. [1]
- hypoxémie: administrer de l'oxygène
- hypotension (EP massive): salin 0.9% IV
- hypotension réfractaire: vasopresseurs
Anticoagulation
L'anticoagulation est de mise chez tous les patients. Chez ceux pour qui l'anticoagulation est contre-indiquée, l'installation percutanée d'un filtre dans la veine cave inférieure peut être envisagée. Le traitement de l'EP se fait en deux phases, l'anticoagulation initiale et celle de maintient.[1]
Initiale
- Héparine IV non fractionnée (HPNF)
- Héparine de bas poids moléculaire SC (HPBM)
- Dalteparin: 100 unités/kg SC q 12h ou 200 unités/kg die
- Enoxaparin: 1 mg/kg SC ou 1.5 mg/kg SC die
- Tinzaparin: 175 unités/kg SC die
- Fondaparinux SC[note 3]
- patient < 50 kg: 5 mg/kg die
- patient 50 - 100 kg: 7.5 mg/kg die
- patient > 100 kg: 10 mg/kg die
- Inhibiteurs du facteur Xa PO (apixaban et rivaroxaban): même doses que pour le maintient
- Argatroban IV (pour les patients souffrant de thrombocytopénie induite l'héparine)
L'HPNF est à privilégier chez les patients dont le risque hémostatique est élevé en raison de sa faible demi-vie et de l'efficacité de l'antidote (protamine). En revanche, elle demande une hospitalisation et un suivi serré car son profil pharmacologique est difficilement prédicitible. Pour les autres patients, l'HPBM ou les anti-coagulants nouvelle génération (ACO: Éliquis ou Xarelto) peuvent être utilisés tant en hospitalisation qu'en ambulatoire car leur profil d'utilisation est prédictible et sécuritaire.
Maintient
- Antagoniste de la vitamine K PO (warfarine)
- Inhibiteurs du facteur Xa PO
- Apixaban: 10 mg po bid 7 jours puis 5 mg po bid
- Rivaroxaban: 15 mg po bid pour 21 jours avec nourriture puis 20 mg die avec nourriture
- Inhibiteur directe de la thrombine PO (dabigatran): 150 mg po bid (un traitement initial de 5-10 jours avec de l'héparine est nécéssaire)
- Héparine de bas poids moléculaire SC[note 4]
- Dalteparine: 2500-5000 unités die
- Tinzaparine: 3500 unités die
La warfarine est le choix le plus courant en thérapie de maintient car sont utilisation a été éprouvée. Chez la plupart des patients, son administration commencera en même temps que la thérapie initiale car il faut compter un délai de quelques jours avant d'atteindre la fenêtre thérapeutique. Cependant, l'INR doit être dosé périodiquement afin d'empêcher l'anticoagulation excessive. Les anticoagulants oraux directs (ACO) peuvent être utilisés tant en thérapie initiale que pour le maintient et on un profil d'utilisation beaucoup plus sécuritaire que la warfarine. Malheureusement, il n'existe pas d'antidote pour la plupart d'entre eux (sauf pour le dabigatran [l'idarucizumab]).
La durée d'administration de l'anticoagulation dépend de nombreux facteurs, notamment ceux du risque de saignement.[note 5] Un facteur de risque de TVP transitoire comme l'immobilisation ou la chirurgie ne demandera qu'une anticoagulation de 3 mois. Un facteur de risque plus permanent d'EP (cancer, thrombophilie, etc.) ou des EPs récurrentes demanderont une anticoagulation à long terme voie à vie pour autant que le risque de saignement soit faible ou modéré.
- âge > 65 ans
- antécédants de saignement
- thrombocytopénie
- thérapie anti-plaquettaire
- chutes fréquentes
- défaillance hépatique
- abus d'alcool
- chirurgie récente
- capacité fonctionnelle réduite
- antécédents d'AVC
- diabète
- anémie
- cancer
- insuffisance rénale
Thrombolyse
Chez les patients dont la fonction du ventricule droit est compromise ou dont les signes vitaux sont gravement affectés par l'EP, la thrombolyse doit être administrée.[1]
- alteplase: 100 mg IV en infusion continue sur 2h
- streptokinase: 250 000 unités IV sur 30 minutes puis 100 000 unités/h pour 24h
- urokinase: 4400 unités/kg IV sur 10 min puis 4400 unités/kg/h IV pour 12h
Les contre-indications absolues de la thombolyse sont:
- un AVC hémorragique antérieur
- un AVC ischémique dans la dernière année
- un saignement actif
- un traumatisme crânien ou une chirugie intracrânienne dans les derniers 2 mois
- une tumeur intracrânienne
Les contre-indications relatives sont:
- une chirurgie récente (il y a moins de 10 jours)
- une diathèse hémorragique (ex: insuffisance hépatique)
- la grossesse
- une ponction récente des veines non compressibles (ex: jugulaire interne, sous-clavière)
- une cathétérisation récente de l'artère fémorale (il y a moins de 10 jours)
- un ulcère peptique
- une hypertension sévère (> 180 mmHg systolique ou > 100 mmHg diastolique)
Pronostic
Il a été estimé que 10 % des victimes d'EP mourront dans les quelques heures suivant la venue des symptômes. De plus, les patients ayant décédé des suites d'une EP n'auront pour la majorité jamais été diagnostiqués de leur vivant, allant même jusqu'à n'avoir jamais été soupçonnés d'avoir une EP.[1]
Complications
- Coeur pulmonaire aigü menant au choc et à la mort
- récidives de PE
- flutter auriculaire
- fibrillation auriculaire
- hypertension pulmonaire chronique
Le traitement de l'EP peut lui aussi ammener son lot de complications, notamment par des saignements causés par l'anticoagulation.
Prévention
Si la section est n'est pas jugée nécéssaire, elle peut être supprimée.
Informations
Étiologie
La quasi totalité des EP originent de thrombus formés dans les jambes ou le bassin (TVP). Les risques peuvent être groupés selon trois catégories (triade de Virchow):
- Stase sanguine: les conditions empêchant le retour veineux, comme l'alitement prolongé ou l'immobilisation.
- Inflammation: les atteintes de causant un dysfonction ou des dommages à l'endothélium vasculaire.
- Hypercoagulabilité: les désordres de la coagulation.
Facteurs de risque
Les facteurs de risque sont les mêmes que pour la TVP. Dans 80 % des cas d'EP, on retrouve une TVP aux membres inférieurs.[3]
| Acquis | |
|---|---|
| Chirurgie dans les 3 derniers mois (spécialement orthopédique) | |
| Trauma | |
| Cancer | |
| Immobilisation | |
| Obésité | |
| Obstétrique | |
| Médicaments | |
| Insuffisance cardiaque congestive | |
| Héréditaires | |
| Thrombophilies | |
Score de Wells pour TVP
| Critères | Points |
|---|---|
| Cancer actif dans les 6 derniers mois en Tx actif ou palliatif | 1 |
| Paralyse, parésie ou immobilisation plâtrée récente du membre inférieur | 1 |
| Alitement récent pendant plus de 3 jours et/ou chirurgie majeure depuis moins de 12 semaines requérant une anesthésie régionale ou générale | 1 |
| Douleur à la pression sur le trajet du système veineux profond | 1 |
| Œdème de tout le membre inférieur | 1 |
| Circonférence du mollet > 3 cm vs autre mollet mesuré à 10 cm sous la tubérosité tibiale | 1 |
| Œdème à godet unilatéral | 1 |
| Veines collatérales superficielles non variqueuses | 1 |
| Antécédent de TVP documenté | 1 |
| Diagnostic alternatif aussi probable ou plus probable | -2 |
niveau de probabilité de TVP:
si <= 1 point: risque, faible 6 %
si >= 2 points: risque élevé 28 %
Pathophysiologie
Conséquences hémodynamiques
L’obstruction des artères pulmonaires par le caillot provoque une augmentation de la résistance vasculaire pulmonaire par le biais de deux mécanismes :
- Oblitération mécanique
- Vasoconstriction humorale médiée par des substances vasoactives provenantdu caillot et potentialisée par l’hypoxie)
Dans les embolies pulmonaires massives (> 50 % du lit vasculaire) ou en présence d’une affection cardiaque ou pulmonaire sous-jacente, le ventricule droit est soumis à une surcharge importante conduisant au cœur pulmonaire aigu. La pression artérielle pulmonaire moyenne générée par le ventricule droit ne peut excéder 40 mmHg chez les patients sans pathologies cardiopulmonaires.[3] Il est donc probable qu'une EP fasse décompenser un vendtricule droit, surtout si celui-ci est déjà compromis.
Conséquences respiratoires
Lorsque le lit vasculaire s’obstrue, il s'ensuit une augmentation de l’espace-mort physiologique qui est caractérisé par une augmentation du rapport ventilation-perfusion (V/Q). Cela s’explique par le fait qu’une zone pulmonaire continue d’être ventilée alors qu’elle ne reçoit aucune perfusion sanguine. L’air admis dans ces alvéoles ne s’enrichit donc pas en CO2 et ne fournit pas d’oxygène au sang. L’hypocapnie prévalant dans les zones d’espace-mort alvéolaire, favorise une pneumoconstriction et une bronchosconstriction. Cela contribue à réduire la ventilation inefficace dans ces zones non fonctionnelles. Cliniquement, ce phénomène se manifeste par une atélectasie. Une augmentation du shunt physiologique dans les zones d’atélectasie est favorisée par la perte de surfactant au pourtour de l’embolie pulmonaire. Mis ensembles, ces mécanismes entrainent une hypoxémie dont la sévérité est proportionnelle à la sévérité de l’embolie.[3]
Épidémiologie
Dans la population générale, l'épidémiologie de l'EP est difficile à déterminer en raison des présentation très variées et des formes sub-cliniques. Cependant, il a été estimé que l'EP affecte 117 personnes par 100 000 personnes-années ce qui équivaut annuellement à 350 000 cas et 85 000 décès par années. Les adultes étant de loin les plus touchés.[1] Parmis la population hospitalisée, la prévalence de la TVP et donc le risque d'EP est largement plus élevée. Aux États-Unis seulement, 547 596 cas de TVP se déclarent annuellement.[4] L'étude ENDORSE a évalué lors d'un recensement de 68 183 patients hospitalisés de plus de 40 ans dans 32 pays entre 2006 et 2007 que 51.8% d'entre eux étaient à risque de TVP[5].
Notes et références
Notes
- ↑ Pour le risque faible, on estime la probabilité à moins de 19%, pour le risque intermédiaire, il est entre 10% et 79% et pour le risque élevé, il est supérieur à 80%.
- ↑ 12% des cas d'EP seront décrits comme peu probables.
- ↑ La dose de fondaparinux est de 50% si la clairance de la créatinine est entre 30-50ml/min; en dessous de 30 ml/min, elle est contre-indiquée.
- ↑ Pour les patients à haut-risque souffrant de néoplasie ou ceux avec des EPs chroniques malgré l'usage d'autres anti-coagulants.
- ↑ Un risque de saignement faible est définit comme n'ayant aucun facteurs de risque, un risque modéré est définit comme ayant un facteur de risque et un risque élevée est définit comme ayant deux ou plus facteurs de risque.
Références
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 et 1,6 Merck Manual: Pulmonary Embolism (PE)
- ↑ P. S. Wells, D. R. Anderson, M. Rodger et I. Stiell, « Excluding pulmonary embolism at the bedside without diagnostic imaging: management of patients with suspected pulmonary embolism presenting to the emergency department by using a simple clinical model and d-dimer », Annals of Internal Medicine, vol. 135, no 2, , p. 98–107 (ISSN 0003-4819, PMID 11453709, lire en ligne)
- ↑ 3,0 3,1 et 3,2 EMBOLIE & HYPERTENSION PULMONAIRES. Dr Lise Tremblay. IUCPQ
- ↑ MMWR Morb Mortal Wkly Rep 2012 8 juin;61:401
- ↑ Étude ENDORSE: Lancet 2008 Feb 2;371(9610):387
