ULaval:MED-1202/Pneumonie
La pneumonie est une affection infectieuse du parenchyme pulmonaire qui touche de façon prépondérante les espaces alvéolaires. La radiologie est obligatoire pour le diagnostic et se caractérise par une infiltration alvéolaire ou interstitielle. La majorité des pneumonies sont de natures infectieuses, qu’elles soient virales, bactériennes, mycobactériennes ou fongiques. Plus rarement, le parenchyme est affecté par des processus inflammatoires ou prolifératifs dont la présentation clinique et radiologique est indissociable de celle des pneumonies infectieuses.
Physiopathologie
Trois mécanismes sont impliqués dans la genèse de pneumonie :
- Micro-aspiration de la flore oropharyngée
- Pathogènes colonisant en 1er les voies aériennes supérieures sont par la suite aspirés dans les voies aériennes inférieures.
- C’est le cas de la majorité des pneumonies bactériennes.
- Inhalation de matériel aérosolisé – inhalation de gouttelettes
- Essaimage hématogène
- Une infection ailleurs se rend aux poumons
- Beaucoup plus rare
- Exemple : embolie pulmonaire septique ou endocardite du cœur droit.
Les mécanismes de défense du poumon sont généralement efficaces pour assurer la stérilité des voies aériennes sous-glottiques, mais ces conditions permettent aux mécanismes ci-haut de jouer plus librement :
- Tabagisme: entrave l’efficacité des mécanismes mucocilliaires chargés de l’élimination des pathogènes inhalés
- Conditions qui nuisent à l’efficacité du réflexe de toux
- Certains troubles neuromusculaires et la paralysie d’une corde vocale qui rendent l’aspiration du matériel dégluti plus fréquente.
- La trachéostomie et le tube endotrachéal qui empêchent l’action de la glotte et donnent un accès direct au tractus respiratoire aux bactéries de la peau et de la sphère ORL.
Types
Les pneumonies sont classifiées en fonction du lieu et de la population ou elles surviennent. Cette classification permet de guider la thérapie antibiotique initiale en fonction des flores bactériennes attendues. On distingue :
- Pneumonie acquise en communauté: affecte des individus immunocompétents vivants dans un environnement domiciliaire normal. Les travailleurs de la santé entrent dans cette catégorie.
- Pneumonie liée aux soins de santé: nouvelle catégorie incluant la population extrahospitalière disposée, par leurs comorbidités ou leur fréquentation hospitalière, à héberger une flore nosocomiale. Ces patients ont une faiblesse immunitaire. Ex : résidents en centre, personnes suivant une chimiothérapie.
- Pneumonie nosocomiale: elle est acquise en milieu hospitalier. La pneumonie doit survenir plus de 2 jours après l’admission du patient ou jusqu’à 14 jours après sa sortie de l’hôpital.
- Pneumonie acquise sous ventilateur: sous-classe de la pneumonie nosocomiale. Acquise après l’intubation endotrachéale chez un patient hospitalisé aux soins intensifs
Facteurs de risque
Voici les facteurs de risque qui modulent l’incidence de la pneumonie acquise en communauté :
- Alcoolisme
- Asthme
- État d’immunosuppression
- Institutionnalisation
- Âge ≥ 70 ans
Les facteurs de risques se multiplient. Les facteurs de risques associés aux autres pneumonies sont plus difficiles à isoler. L’âge, les comorbidités pulmonaires, cardiaques et le diabète sont souvent retrouvés. La durée de ventilation mécanique est un facteur déterminant de la pneumonie acquise sous ventilateur. Chaque jour, le risque de pneumonie augmente de 2%.
Incidence
La pneumonie acquise en communauté est l’infection qui mène au plus grand nombre d’hospitalisation en Occident. Au Québec, 50 000 pneumonies sont diagnostiquées annuellement, 20% nécessitant une hospitalisation. La pneumonie nosocomiale est la 2e infection acquise en milieu hospitalier après l’infection urinaire. Les diverses formes de pneumonies représentent la 6e cause de mortalité en Amérique.
Agents étiologiques
On identifiera un agent étiologique dans très peu de pneumonies. Très peu d’agents étiologiques sont responsables des pneumonies. Ainsi, les antibiotiques de 1e intention couvrent adéquatement ceux-ci.
La flore pathogène responsable des pneumonies acquises en communauté est relativement limitée et homogène d’un milieu à l’autre. Il en est tout autrement de celle responsable des pneumonies nosocomiales qui varie beaucoup en fonction des milieux et des caractéristiques des patients. Dans ce cas, on recherchera avec plus d’insistance le pathogène au moyen de cultures.
- Agents étiologiques des pneumonies acquises en communauté : Streptococcus pneumoniae (44%)
- Agents étiologiques des pneumonies nosocomiales : Pseudomonas aeruginosa (24%)
Présentation clinique
Le diagnostic de pneumonie repose sur la reconnaissance clinique d’un syndrome constitué de :
- Toux
- Expectorations colorées
- Fièvre (>38oC)
- Dyspnée
- Malaises généraux
- Douleur thoracique de type pleurale
Ces signes sont souvent associés à des signes physiques auscultatoires :
Ces signes et symptômes varient avec l’âge. Les patients aux extrêmes de l’âge ne présentent souvent qu’une atteinte non spécifique de l’état général ou de la confusion. La démonstration radiologique de la pneumonie est nécessaire à l’établissement d’un diagnostic de certitude.
| Pneumonie typique | Pneumonie atypique |
|---|---|
|
|
- Au cours de l’été 2012, la région de Québec a été le siège d’une des plus importantes éclosions d’infection à la Legionella pneumophilia.
- Il s’agit d’une bactérie Gram négatif qui se transmet de l’environnement à l’homme par inhalation de microgouttelettes contaminées. Aucune transmission inter-humaine n’a à ce jour été rapportée.
- L’habitat naturel de cette bactérie est l’eau douce stagnante ou elle est hébergée par des amibes. On la retrouve donc dans les tours de refroidissement, systèmes de climatisations, piscines et étang.
- Elle infecte essentiellement les personnes âgées ou médicalement compromises,
- Classiquement, après une incubation de 2 semaines, la Legionella pneumophilia réalise un tableau de pneumonie atypique au cours duquel les céphalées et les troubles digestifs sont prépondérants.
- Le diagnostic d’infection à la Legionella pneumophilia s’établit sur la suspicion clinique et la présence d’antigénémie urinaire.
- Le Legionella pneumophilia est une pathogène intra-cellulaire. Il est insensible aux pénicilines et requiert des antibiotiques qui pénètrent bien le corps cellulaire.
- Les macrolides, quinolones et tétracylines sont des options thérapeutiques viables.
Investigation clinique
La très grande majorité des pneumonies sont acquises en communauté et seront traitées sur une base externe avec une antibiothérapie orale. Le seul examen dans ce contexte est la radiographie pulmonaire qui confirme le diagnostic. Les signes cliniques et physiques ne sont pas spécifiques.
Chez les patients dont la présentation clinique est sévère, qui sont plus vulnérables et chez ceux porteurs de pneumonies liées aux soins de santé, nosocomiale ou acquises sous ventilateurs, une investigation supplémentaire est nécessaire. Pour dépister des conditions ou complications associées à la pneumonie, de stratifier le risque de morbidité et de mortalité et de moduler les décisions thérapeutiques. D’autres examens seront effectués afin d’identifier l’agent causal et de mieux adapter l’antibiothérapie.
Ces examens sont effectués chez pratiquement tout patient admis pour pneumonie:
- Formule sanguine
- Bilan ionique
- Fonction rénale – module l’antibiothérapie et donne l’index pronostic
- Fonction hépatique – module l’antibiothérapie
- ECG – pour voir les complications associées et moduler l’antibiothérapie
Recherche étiologique
Coloration de Gram et culture des expectorations

Pour la majorité des patients traités en ambulatoire, il n’y a pas d’investigation bactériologique spécifique recommandée. Pour les patients admis à l’étage, il est recommandé que la culture et la coloration de Gram soient obtenues avant l’administration d’un antibiotique. La difficulté d’obtenir un spécimen adéquat ne doit jamais retarder l’initiation du traitement. Cependant, il faut réaliser que ce test n’est si sensible n’y spécifique pour le diagnostic d’un agent étiologique.
Hémoculture
Mise en culture d’échantillons sanguins. Sa positivité définit la bactériémie. La positivité augmente avec le sévérité de la maladie et diminue si des antibiotiques ont été administrés préalablement. Elle est positive dans 6 à 17% des pneumonies et le germe le plus souvent isolé est S. pneumoniae. La mortalité est souvent plus élevée en présence d’une bactériémie.
Thoracentèse
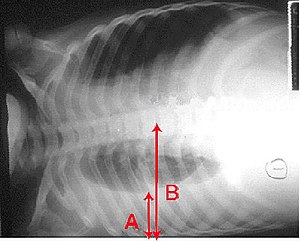
Tout patient qui présente un épanchement pleural significatif (> 10 mm en décubitus latéral) devrait avoir une ponction pleurale. La mise en évidence de pus dans l’espace pleural définit l’empyème, une complication rare de pneumonies. Plus fréquent avec infection à S. pneumoniae. S’il y a présence d’un épanchement para-pneumonique compliqué, on doit procéder à un drainage. L'épanchement démontre des bactéries à la coloration et à la culture ou le pH du liquide est inférieur à 7.20.
Antigénémie urinaire pour Legionella pneumophilia
Partie intégrante de l’investigation de routine de la pneumonie sévère. Ce test identifie seulement Legionella pneumophilia sérogroupe type I, qui est le plus fréquent. Un test positif est diagnostic.
Autres méthodes diagnostiques
La sérologie n’est pas recommandée de routine. Elle s’applique surtout dans les cas d’épidémie. Elle nécessite un prélèvement précoce et tardif. Sa valeur repose sur l’augmentation par un facteur 4 du nombre d’anticorps entre les deux prélèvements. Moins de 40% des pneumonies investiguées voient leur agent étiologique positivement identifié. Le traitement est donc basé sur une approche empirique basée sur la probabilité.
Triage – traitement ambulatoire versus hospitalisation
Une fois le diagnostic de pneumonie suspecté ou confirmé, le médecin doit prendre la décision du lieu de traitement et de l’antibiothérapie. La majorité des patients, soit 80%, seront traités sur une base externe et leur mortalité sera faible. La mortalité chez le patient admis est plus grande, atteignant jusqu’à 25% pour le patient aux soins intensifs. La décision d’hospitalisation doit être individualisée. C’est ce qu’on appelle le triage des patients. Pour aider le clinicien dans cette décision plusieurs scores ont été créés.
Score de Fine
Aide à identifier les patients avec un faible risque de mortalité. Théoriquement, si le risque de mortalité est faible, le patient pourra être traité en externe. Permet de stratifier les patients en 5 classes. C’est une règle qui procède en 2 étapes:
Patient âgé de plus de 50 ans ?
- Oui : assigner au patient le niveau de risque II à V selon l’étape 2
- Non: ATCD de maladie ou condition morbide? (Néoplasie, Défaillance cardiaque, Maladie cérébrovasculaire, Maladie rénale, Maladie hépatique)
- Oui : assigner au patient le niveau de risque II à V selon l’étape 2
- Non: Présence d’anomalies à l’examen physique? (Confusion ou atteinte de l’état mental, FC > 125 min, FR > 30 min, TA systolique < 90 mmHg, Température < 35 ou > 40)
- Oui : risque II à V selon étape 2
- Non : RISQUE DE NIVEAU I
Si le patient a plus de 50 ans ou répond oui à une des questions, on passe à la 2e étape ou on accorde un pointage à des données démographiques, diverses comorbidités, anomalies à l’examen physique et de laboratoire. Ensuite, selon la classe, on voit le risque de mortalité.
L’application d’une telle règle diminue le nombre d’hospitalisations. Cependant, elle ne tient pas compte du patient immunosupprimé, d’un patient MPOC ou porteur de troubles neuromusculaires. Elle ne considère également pas les facteurs de vulnérabilité psychosociale qui motivent souvent l’admission de patients porteurs de pneumonies qui auraient autrement pu être traités sur base externe. Ce n’est qu’un guide général qui ne remplace pas le jugement clinique.
Score CURB-65
Il est plus simple que l’algorithme de Fine. C’est un véritable outil de triage. Sa simplicité et sa robustesse en ont fait le score choisi par le ministère de la Santé pour effectuer le triage pré-hospitalier dans l’éventualité d’une pandémie d’influenza.
| CURB-65 | |
|---|---|
| C | confusion nouvelle |
| U | urée ≥ 7 mmol/l – signe d’une insuffisance rénale |
| R | FR ≥ 30 |
| B | Pression artérielle systolique < 90 mmHg ou tension artérielle diastolique < 60 mmHg. |
| 65 | âge ≥ 65 ans. |
Chaque élément du score se voit attribuer 1 point. La somme du pointage permet une prédiction de la mortalité et conséquemment des mesures à prendre pour la prévenir.
Un score supérieur à 2 est généralement considéré comme une indication d’hospitalisation.
Traitement
L’antibiothérapie sera initialement et le plus souvent totalement empirique, c’est-à-dire qu’on se base sur l’étiologie probable de la pneumonie pour choisir la couverture antibiotique. Ceci s’oppose à une thérapie ciblée que seule permet la mise en évidence du pathogène responsable. Pour les patients chez qui l’on obtiendra une telle identification, la thérapie empirique initiale sera ajustée à une thérapie ciblée.
Pénicillines
- Bactéricides par leur action amenant la destruction de la paroi bactérienne.
- Grande variété de pénicillines synthétiques avec spectre de couverture variant largement.
- Bien tolérées à l’exception de quelques réactions allergiques cutanées.
- Activité contre le pneumocoque limitée ces dernières années par l’émergence de souches résistantes dû à l’usage intense de cette classe d’antibiotique.
- Pas efficace contre les germes atypiques.
Céphalosporines
- Dérivées des pénicillines, partagent les mécanismes d’action et le spectre d’activité
- Grande variété qui permet de les utiliser contre une multitude d’infections respiratoires.
- Le taux d’allergie croisée entre les pénicillines et les céphalosporines varie de 0 à 20%.
- Une anaphylaxie à la pénicilline interdit le recours aux céphalosporines
Carbapénems
Dans la famille étendue des pénicillines
- Antibiotiques développés pour lutter contre des infections sévères ou poly-microbiennes
- Leurs spectres couvrent virtuellement l’ensemble des pathogènes bactériens à l’exception des bactéries atypiques et des formes résistantes de staphylocoques.
- Disponibles qu’en formulation intra-veineuse
- En plus d’allergies croisées aux pénicillines, elles abaissent le seuil épileptique.
- Agents chers, mais très utiles dans l’environnement des soins intensifs.
Macrolides
- Agissent en bloquant la synthèse protéique au sein des ribosomes. Une inhibition prolongée de cette synthèse mène à la mort cellulaire.
- Spectre d’action bien adapté à la couverture des infections du tractus respiratoire.
- L’intolérance digestive, la prolongation de l’intervalle QT, de nombreuses interactions médicamenteuses et l’émergence de souches de pneumocoques résistantes sont à considérer lors de la prescription.
- 1er choix du traitement empirique lors de la pneumonie acquise en communauté.
Quinolones
- La 4e génération est dirigée contre les infections respiratoires.
- Son spectre plus étendu que celui des macrolides, l’excellente tolérance et le nombre limité d’effets secondaires en ont fait une classe très populaire et possiblement surutilisée. Malgré cela, le profil de résistance demeure excellent.
- Antibiotiques qui empêchent la réplication nucléaire de l’information génétique des bactéries.
- Elles sont contre-indiquées chez la femme enceinte et chez l’enfant.
- La ciprofloxacine, un agent de 2e génération, est la seule molécule orale actuellement efficace contre les infections à Pseudomonas aeruginosa.
- 1er choix du traitement empirique pour les pneumonies reliées aux soins de santé ou nosocomiales.
Aminosides
- Largement abandonnés
- Toxicité rénale et auditive
- Disponible uniquement sous forme intra-veineuse
- Très actifs seuls contre les bactéries Gram négatives et en synergie contre les staphylocoques.
- Ils bloquent la synthèse protéique au niveau des sous-unités ribosomales.
Sulfonamides
- Effet bactéricide par inhibition du métabolisme des folates.
- Des agents plus puissants de cette famille sont utilisés en chimiothérapie oncologiques.
- La plupart des pathogènes respiratoires courants sont maintenant résistants à ces agents.
- Ils sont utilisés dans le traitement et la prophylaxie des infections pulmonaires retrouvés chez les sidéens et autres grands immunosupprimés.
Tétacyclines
- Inhibent la traduction de l’ARN au niveau du ribosome.
- L’émergence de formes résistantes des différents pathogènes qu’elles ciblaient, leurs nombreux effets secondaires et les interactions médicamenteuses les auront repoussés aux lignes arrières de l’antibiothérapie.
Suivi
Dans un certain nombre de cas, l’identification par culture, antigénémie ou sérologie du pathogène responsable permettra de mieux cibler l’antibiothérapie et d’en réduire le spectre nécessaire. On appelle ce passage à une thérapie ciblée la désescalation.
Lorsque la voie parentérale (IV) est utilisée pour la délivrance de l’antibiothérapie, on doit tenter de passer en formulation orale dès que possible et d’éventuellement compléter la thérapie à domicile. Cette transition est généralement possible si les critères suivants sont réunis :
- Amélioration de l’état clinique – diminution de la toux et de la détresse respiratoire
- Absence de fièvre – 2 mesures à 8h00 d’intervalle
- Absence d’un pathogène resistant
- Absence de maladies concomitantes instables
- Absence de complications
- Tube digestif intact
- Leucocytose en retrait
Aucun consensus définitif n’existe sur la durée de l’antibiothérapie, mais sur une base externe, on considère en général que 10 jours de thérapie suffisent. En parentéral, on juge que la majorité des pneumonies peuvent être traitées en 8 jours d’antibiothérapie. Certains pathogènes, tels Pseudomonas aeruginosa et Staphyloccoque aureus commanderont respectivement 14 et 21 jours de traitement.
En plus d’étendre la durée de l’antibiothérapie, un empyème constitue une indication pratiquement formelle de drainage thoracique.
Radiographie pulmonaire de contrôle
Il n’est indiqué de reprendre la radiographie pulmonaire en cours de traitement que si la condition clinique du patient ne s’améliore pas dans les 48-72 heures ou se détériore.
Après le congé, il est souhaitable de procéder à une radiographie entre 4 à 8 semaines après la fin de l’antibiothérapie et de la répéter jusqu’à la normalisation particulièrement chez le patient à risque de néoplasie[note 1]. Pas avant 4 semaines car la pneumonie sera encore là à la radiographie. Chez le jeune, la pneumonie prend 6 semaines à disparaître de la radiographie.
Le problème de la résistance
Au cours des dernières années, on a assisté à une progression puis à une stabilisation des taux de résistance des microbes usuels aux antibiotiques de 1ère ligne. Les causes en sont multiples :
- Usage abusif
- Prescription d’antibiotique dans des circonstances ne le nécessitant pas (bronchite virale, rhume)
- Usage de dosages insuffisants
- Problèmes d’observance thérapeutique
Au Québec, le pourcentage de streptococcus pneumoniae résistant à la pénicilline se situe maintenant à 17.5%. Ce qui fait en sorte que les coûts de traitement et la durée de séjour augmentent.
Prévention
L’arrêt tabagique et la consommation raisonnable d’alcool sont des étapes importantes dans la prévention. La vaccination contre l’influenza et le pneumocoque des populations vulnérables en font aussi partie. Le vaccin contre les infections à pneumocoque a été démontré efficace chez le sujet sain, la personne âgée ou chez la personne atteinte d’une maladie chronique. Le vaccin actuel induit une immunité limitée et nécessite une nouvelle immunisation à intervalles de 6 à 10 ans.
Plusieurs pneumonies dans le même lobe dans la même année est un signe de corps étranger ou de tumeur alors que plusieurs pneumonies dans des lobes différents est un signe de problème d’immunité.
Notes
- ↑ Une consolidation pneumonique à la radiographie peut avoir caché la tumeur qui en était la cause.
