ULaval:MED-1200/Biochimie et métabolisme/Métabolisme des acides aminés
| Concept | |
 | |
|
|
Si la section est n'est pas jugée nécessaire, elle peut être supprimée.
| Description: | |
| Formats: | Texte |
| Balises sémantiques: | |
| Commentaires: | |
| Exemple: | |
Introduction
1. Généralités sur les acides aminés
1.1 Définition
Les acides aminés sont des composantes essentiels dans la formation de protéines, qui rappelons-le, sont essentielles au fonctionnement de l’organisme et jouent des rôles importants dans les réactions chimiques, le transport des substances, la composition des cellules, etc.
1.2 Structure de base
La structure de base d’un acide aminé est : un carbone attaché à un groupement acide (carboxyle), à un groupement amine et à un radical /chaîne latérale ( un groupement contenant des carbones).

Les acides aminés sont divisés en 2 catégories: les non essentiels ( ceux qui sont produits par l’organisme ) et les essentiels (ceux qui ne sont pas produits par l’organisme, mais qui proviennent de l’alimentation et que l’on consomme en ingérant des protéines alimentaires).
1.3 Production d’acides aminés:
Lorsque l’organisme produit des acides aminés, il le fait via une réaction qui se nomme la transamination, c’est-à-dire l’ajout d’un groupement amine sur une molécule organique (à base de carbone).
Voici deux réactions de transamination pour produire les acides aminés non essentiels suivants: l’alanine et l’aspartate.
IMAGE
La phénylalanine hydroxylase, une enzyme que l’on retrouve principalement dans le foie, participe à une réaction irréversible, c’est à dire que la réaction ne peut se faire que d’un sens ( dans le dessin ci-bas, de de la gauche vers la droite). Cet enzyme transforme un acide aminé essentiel (la phénylalanine) en un acide aminé non essentiel, la tyrosine.
Maladies
2.1 Phénylcétonurie
Un déficit en phénylalanine hydroxylase entraîne une maladie nommée la phénylcétonurie. Cette condition est ainsi nommée car elle provoque une augmentation d’un groupe de cétone (le phényl) dans l’urine. C’est une maladie à dépistage obligatoire au Québec et dont le dépistage se fait environ deux jours après la naissance.
Symptômes
- Retard mental : Si la maladie n’est pas traitée, le surplus de phénylalanine dans le corps entraîne de de graves dommages au cerveau de l’enfant, qui grandit avec un retard mental. Toutefois, si la maladie est prise en charge dès la naissance, les enfants grandissent avec un quotient intellectuel presque normal.
- Une peau, des cheveux et des yeux pâles. Ceci est dû au fait que la phénylalanine hydroxylase est un précurseur de la mélanine, la molécule responsable de leur pigmentation. Ainsi, un déficit de l’enzyme produit un déficit en mélanine, et une diminution de la pigmentation générale.
Traitement
Les adultes qui vivent avec cette condition doivent adopter un régime alimentaire spécial dans lequel l’apport de phénylalanine est réduit afin d’empêcher une concentration sanguine augmentée de cet acide aminé.
2.2 Tyrosinémie :
Une autre maladie fait l’objet d’un dépistage à la naissance au Québec: la tyrosinémie. Il s’agit d’une déficience au niveau de l’enzyme qui dégrade la tyrosine en fumarate et acétoacétate. L’incidence de cette maladie est beaucoup plus élevée dans la région du Saguenay-Lac-Saint-Jean qu’ailleurs dans le monde.
La tyrosine est le précurseur de plusieurs produits azotés que l’on retrouve dans de nombreux tissus humains. Parmi les produits azotés, on retrouve les catécholamines (dopamine, noradrénaline et adrénaline) qui servent de neurotransmetteurs dans les systèmes nerveux; la mélanine, qui nous protègent des rayons UV, et les hormones thyroïdiennes, qui agissent dans le métabolisme.
Les acides aminés en tant que précurseurs du glucose et de corps cétoniques
Les acides aminés peuvent également être transformés en glucose et en corps cétoniques pour fournir de l’énergie aux tissus humains lorsque leurs réserves de glucose sont diminuées.
Types d’acides aminés
- Les acides aminés glucoformateurs forment du glucose: Ils perdent leur groupement aminé par dégradation et leur partie carbonée est soit transformée en pyruvate, soit en un composé du cycle de Krebs, et finira par produire du glucose.
- Les acides aminés cétogènes produisent des corps cétoniques: Ils perdent leur groupement aminé par dégradation et leur partie carbonée est soit transformé en Acétyl-coA (et donnera éventuellement un corps cétonique), soit en acétoacétate directement qui est un corps cétonique).
- Les acides aminés mixtes quant à eux seront capables de donner du glucose ET des corps cétoniques. En effet, à la suite de leur désamination une partie de leur squelette carboné entamera le processus pour donner du glucose et l’autre partie donnera des corps cétoniques.
- La phénylalanine et la tyrosine agissent en tant qu’acides aminés mixtes dans certaines situations. Ces deux acides aminés produisent du fumarate (qui éventuellement deviendra du glucose) ET de l’acétoacétate lorsque le rapport insuline/glucagon est bas. Ceci arrive dans ces deux circonstances: chez une personne diabétique non traitée et chez une personne à jeûn ( ↓sucre dans son sang).
Les mécanismes de dégradation des acides aminés
Lorsqu’un individu ingère des aliments contenant des protéines alimentaires, les protéines sont dégradées en acides aminés dans le tube digestif par deux enzymes particulières : les protéases et les peptidases. Les acides aminés atteignent ensuite la circulation sanguine par le système porte, qui relie les capillaires sanguins du système digestif au foie. Si le corps a suffisamment de glucose, les acides aminés serviront à la synthèse protéique. Les acides aminés en surplus sont dégradés, et ce, principalement dans le foie et dans les muscles.
4.1 Processus de dégradation des acides aminés:
Lors de la dégradation, le groupement amine des acides aminés se retrouve sous forme de glutamate lors d’un processus de transamination, pour ensuite devenir de l’ammoniac ( voir section par un processus de désamination oxydative du glutamate. Lors de la première phase, c’est l’a-cétoglutarate qui capte le groupement amine pour devenir du glutamate, mais lors de la 2e phase, le glutamate retourne sous sa forme de a-cétoglutarate pour fournir de l’ammonium.

Il faut faire la distinction entre le groupement amine et le groupement amide.
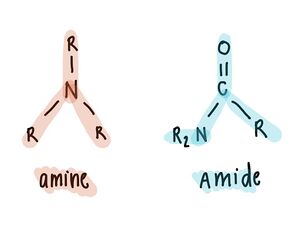
Lorsqu’un groupement amine est libéré d’une molécule, on nomme cette réaction une désamination, et lorsque c’est un groupement amide qui est libéré, la réaction se nomme une désamidation. Lors de la dégradation des acides aminés, une des deux réactions aura lieu, selon la classe moléculaire de l’acide aminé en question. Par exemple, la glutamine et l’asparagine, deux acides aminés, produisent de l’ammoniaque dans le foie par désamidation.
5. Élimination de l’ammoniaque
5.1 Définitions des termes ammoniac, ammoniaque et ammoniémie
Démystifions d’abord les termes ammoniac, ammoniaque et ammoniémie.
- L’ammoniac : NH₃ est un gaz.
- L’ammoniaque : Mélange de NH3 dans H20 qui forme du NH4OH et qui s'ionise en ions
ammonium (NH4+) et hydroxyle.
- Ammoniémie: Taux d’ammoniaque retrouvé dans le sang ce qui veut dire la somme
des espèces moléculaires suivantes: NH3, NH4OH et NH4+.
Comme l’ammoniaque produit par la dégradation des acides aminés est toxique pour l’organisme en surtout pour le cerveau, le corps s’en débarrasse dans l’urine sous forme d’urée en suivant le cycle de l’urée ou sous forme d’ammonium, simplement en libérant les ions NH4+ provenant des muscles et du cerveau dans l’urine.
5.2 Le cycle de l’urée
Le cycle de l’urée est le suivant : (NB: il est plus facile de suivre le trajet en commençant par les acides aminés)
IMAGE
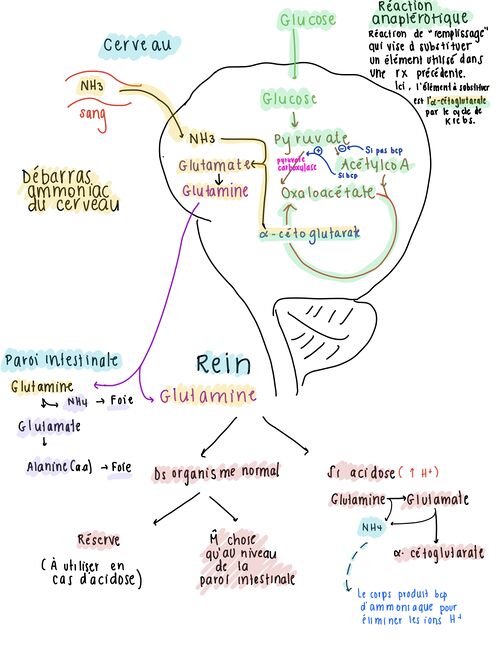
5.3 Élimination de l’ammoniaque par le cerveau
Comme certaines molécules d’ammoniaque arrivent tout de même à rester dans le sang et sont donc acheminées dans le cerveau, le cerveau se doit de l’éliminer rapidement. Voici comment il s’y prend:
Notes
Si la section est n'est pas jugée nécessaire, elle peut être supprimée.
| Description: | Dans la section notes se trouve toutes les notes de bas de page (références du groupe "note" [ou autres]). |
| Formats: | Texte |
| Balises sémantiques: | |
| Commentaires: | Pour ajouter des notes, passez par la fonction d'ajout de notes. Il est aussi possible d'ajouter des notes d'autres groupes, comme "pharmaco", "pédiatrie", "indications", etc. Classez ces autres groupes de notes dans des sous-sections. N'ajoutez pas de notes manuellement. |
| Exemple: | TRAITEMENTS
Les traitements:
NOTES Gériatrie
Pédiatrie
|
Références
Toute contribution serait appréciée.
| Description: | Dans la section références se trouve toutes les références (références sans groupe). Pour ajouter des références, passez par la fonction d'ajout de références. N'ajoutez pas de références manuellement. |
| Formats: | Texte |
| Balises sémantiques: | |
| Commentaires: | |
| Exemple: | |
