Hémorragie digestive haute (approche clinique)
| Approche clinique | |||
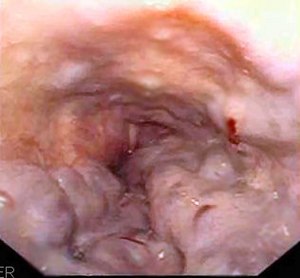 Varices oeosophagiennes | |||
| Caractéristiques | |||
|---|---|---|---|
| Examens paracliniques | Formule sanguine complète, Frottis sanguin, Bilan hépatique, Albumine, Bilan ferrique, INR, TCA, Créatininémie, Angiographie, Grouper, ... [+] | ||
| Drapeaux rouges |
Pâleur, Dyspnée (symptôme), Tachycardie (signe clinique), Altération de l'état de conscience (signe clinique), Syncope (symptôme), Douleur thoracique (symptôme), Hypotension artérielle (signe clinique), Diaphorèse (signe clinique), Antécédents personnels de varices oesophagiennes, Antécédents personnels de cirrhose hépatique, ... [+] | ||
| Informations | |||
| Terme anglais | Upper gastro-intestinal bleeding | ||
| Autres noms | Saignement digestif haut | ||
| SNOMED CT ID | 37372002 | ||
| Spécialités | Gastro-entérologie, Chirurgie générale, Médecine d'urgence, Médecine interne, Soins intensifs | ||
| |||
Hémorragie digestive haute (6-1)
L'hémorragie digestive haute (HDH) se définit par un saignement gastro-intestinal en amont de l'angle de Treitz. Si le saignement est en aval, on parlera alors d'hémorragie digestive basse.
Épidémiologie
L'HDH est un problème courant ayant une incidence annuelle d'environ 80 à 150 pour 100 000 habitants, avec des taux de mortalité estimés entre 2% et 15%.[1] L'HDH représente 75% de tous les cas d'hémorragie gastro-intestinale aiguë et 80% des hémorragies digestives significatives. [1] De plus, selon un sondage, l'incidence annuelle des saignement non-variqueux est en diminution, passant de 78 à 61 cas par 100 000 personnes de 2001-2009. [2] La mortalité à 30 jours d'un saignement non-variqueux est évaluée à 11% contrairement à 20% en 6 semaines pour un saignement variqueux [2][3].
Étiologies
Les étiologies les plus fréquentes comprennent [4][1] :
- les étiologies non variqueuses (80%) :
- l'ulcère gastroduodénal (40% à 50%)
- l'oesophagite érosive (11%)
- la duodénite (10%)
- le syndrome de Mallory-Weiss (5% à 15%)
- les malformations vasculaires (5%)
- les tumeurs (2%)
- les autres étiologies (5%)
- les étiologies variqueuses (20%) :
- les varices gastro-oesophagiennes (>90%)
- la gastropathie hypertensive (< 5%)
- les varices gastriques (rare).
Chez les personnes âgées, l'ulcère peptique et l'angiodysplasie sont les causes les plus fréquentes de saignements. Le saignement variqueux est moins fréquent que chez les plus jeunes.[5]
Approche clinique
Questionnaire
Lors du questionnaire, une attention particulière doit être portée aux éléments suivants [6][5]:
- les symptômes suggestifs d'un saignement (la quantité de sang et la chronologie) :
- la présence d'une hématémèse
- la présence de méléna[note 1][7]
- la présence d'une hématochézie (habituellement suggestive d'une HDB, mais peut également indiquer une HDH)
- les signes et symptômes associés :
- la syncope, la lipothymie, les étourdissements ou l'hypotension orthostatique (si le saignement est suffisamment sévère)
- l'asthénie et la fatigue
- la douleur abdominale
- les vomissements
- la dysphagie
- l'ictère
- les symptômes B.
- les comorbidités
- la cirrhose hépatique (étiologies variqueuses)
- l'anévrisme de l'aorte abdominale (fistule aorto-entérique)
- l'ulcère gastroduodénal
- une coagulopathie
- l'anémie.
- la prise concomitante de médicaments :
- les éléments orientant vers un pseudo-méléna [8] :
- le pepto-Bismol
- le boudin
- le fer
- la consommation d'alcool.
Examen clinique
Voici les éléments à rechercher lors de l'examen physique :
- les signes vitaux (Dépister le choc hémorragique) :
- la présence d'HTO
- les signes suggestifs d'un choc hémorragique
- la tachycardie
- l'hypotension artérielle
- la tachypnée
- une diurèse abaissée
- de l'anxiété.
- l'examen abdominal
- une épigastralgie pourrait faire penser à un ulcère
- les examens cardiaque et pulmonaire
- l'examen ORL
- certains épistaxis se déguisent parfois en HDH
- les signes d'atteinte hépatique chronique :
- l'érythème palmaire
- les angiomes stellaires
- la gynécomastie
- l'ictère
- l'ascite
- le toucher rectal (Dépister le choc hémorragique) (l'apparence des selles peut orienter sur la localisation du saignement, mais elle n'est pas un bon indicateur)[9].
Drapeaux rouges
Les signaux d'alarme suivants suggère une hypovolémie ou un choc hémorragique[10] :
- la syncope
- l'hypotension
- la pâleur
- la diaphorèse
- la tachycardie
- la douleur thoracique
- la dyspnée
- l'altération de l'état de conscience
- des antécédents personnels de varices oesophagiennes
- des antécédents personnels de cirrhose hépatique
- des antécédents récents de chirurgie aortique.
Investigation
Tests de laboratoire
Les examens sanguins suivants sont utiles dans l'investigation d'une HDH [1][11][12][13][14] :
- la formule sanguine complète : pour rechercher les niveaux actuels d'hémoglobine, d'hématocrite et de plaquettes
- la créatininémie et l'urée : une créatinine élevée ou un rapport urée/créatine élevé peut également être un signe d'HDH
- le grouper/croiser
- l'INR/TCA
- le bilan hépatique
- l'albumine
- le frottis sanguin
- un VGM faible peut indiquer une perte de sang chronique et une anémie ferriprive
- cet examen est moins pertinent en aigu
- le bilan martial et les réticulocytes (pas essentiel si saignement manifeste).
Endoscopie gastro-oesophagienne
L'OGD est la modalité d'investigation de choix pour l'HDH. Voir la section Traitement.
Tube nasogastrique
L'aspiration par tube nasogastrique lors de l'investigation des HDH est controversée[9][15]. Habituellement, cette technique est utilisée afin de clarifier si l'origine du saignement provient de la partie supérieure à l'angle de Treitz (davantage utilisée en contexte de méléna ou d'hématochézie)[9]. Ainsi, si l'aspirat a un aspect bilieux, on pensera davantage à une hémorragie digestive basse[16]. Cependant, si le liquide observé a une autre apparence, cela oriente vers une HDH et la gastroscopie est indiquée. Considérant la littérature actuelle, il n'est pas recommandé d'effectuer un lavage par TNG d'emblée[1][15][17].
Autres modalités
Les autres modalités d'investigation comprennent [1] :
- l'angiographie (modalité de choix en deuxième ligne)
- la colonoscopie (indiquée si l'endoscopie est normale et qu'il y a présence de méléna ou d'hématochézie).
Stratification des patients
Il existe deux principaux scores utilisés dans la prise en charge des saignements digestifs haut, soit le score de Rockall et le score de Blatchford.
Score de Rockall
L'objectif du score de Rockall est de prédire la récidive hémorragique et le risque de mortalité.
Lorsque le score de Rockall est utilisé, les patients avec deux points ou moins sont considérés comme à faible risque et ont 4,3% de risque de récidive du saignement et 0,1% de risque de mortalité. En revanche, les patients avec un score de six ou plus ont un taux de récidive de 15% et une mortalité de 39% .[14]
Il existe également un Rockall pré-endoscopique qui peut être utilisé pour stratifier le risque de nouveau saignement et de mortalité du patient avant même l'évaluation endoscopique. Cependant, l'AGA-CAG n'a pas pu émettre de recommandation à l'égard de son utilisation[2].
| Score de Rockall[18] | ||
|---|---|---|
| Variables | Réponse | Score |
| Âge | < 60 ans
60-79 ans > 80 ans |
0
1 2 |
| Signes hémodynamiques
de choc |
Aucun
Pouls > 100/min et TAS > 100 mmHg Pouls > 100/min et TAS < 100 mmHg |
0
1 2 |
| Comorbidités | Aucune
Insuffisance cardiaque, cardiopathie ischémique ou comorbidité majeure Insuffisance rénale, insuffisance hépatique ou néoplasie métastatique |
0
2 3 |
| Diagnostic | Mallory Weiss
Tout autre diagnostic Néoplasie digestive |
0
1 2 |
| Stigmates d'hémorragie récente | Aucuns
Présence de sang, caillot adhérent ou vaisseau visible |
0
2 |
Score de Blatchford
Le score de Blatchford est utile pour prédire la nécessité d'une intervention endoscopique (meilleur que le Rockall pour cet objectif[1]).
L'AGA-CAG recommande d'utiliser un score de Blatchford d'un ou moins pour identifier les patients à faible risque de re-saignement qui ne requièrent habituellement pas d'hospitalisation ou de thérapie endoscopique. [2] Un score de six ou plus est associé à un risque supérieur à 50% de nécessiter une intervention.[14]
| Marqueur | Facteurs de risque à l'admission | Score |
|---|---|---|
| Urée (mmol/L) | 6.5-8.0
8.0-10.0 10.0-25.0 > 25 |
2
3 4 6 |
| Hémoglobine pour les homme (g/dL) | 12.0-13.0
10.0-12.0 < 10.0 |
1
3 6 |
| Hémoglobine pour les femmes (g/dL) | 10.0-12.0
< 10.0 |
1
6 |
| Tension artérielle systolique (mmHg) | 100-109
90-99 90 |
1
2 3 |
| Autres marqueurs | Fréquences cardiaques > 100/min
Présentation avec méléna Présentation avec syncope |
1
1 2 |
Traitement
Évaluation des pertes sanguines
Avant toute réplétion volémique, que ce soit par produit sanguin ou par des solutés de cristalloïdes, il est essentiel d'évaluer les pertes sanguines cliniquement. Ce tableau permet d'évaluer les pertes sanguines.
| CLASSE I | CLASSE II | CLASSE III | CLASSE IV | |
|---|---|---|---|---|
| Perte sanguine (mL) | Jusqu'à 750 | 750-1000 | 1500-2000 | >2000 |
| Perte sanguine (%) | Jusqu'à 15 % | 15 %-30 % | 30 %-40 % | >40 % |
| Fréquence cardiaque | <100 | >100 | >120 | >140 |
| Tension artérielle | Normale | Normale | Diminuée | Diminuée |
| Pression de pouls (mmHg) | Normale ou augmentée | Diminuée | Diminuée | Diminuée |
| Fréquence respiratoire | 14-20 | 20-30 | 30-40 | >35 |
| Débit urinaire (mL/h) | >30 | 20-30 | 5-15 | Négligeable |
| État mental | Normal ou légèrement anxieux | Légèrement anxieux | Anxieux et confus | Confus ou léthargique |
| Remplacement liquidien (règle 3:1) | Crystalloïdes | Crystalloïdes | Crystalloïdes et transfusions sanguines | Crystalloïdes et transfusions sanguines |
Première ligne
| Médicament | Commentaires |
|---|---|
| Produits sanguins | Afin de prévenir l'apparition d'un état de choc, une réplétion volémique devrait être effectuée chez les patients instables hémodynamiquement [2]. Étant donné qu'il s'agit d'une situation dans laquelle un choc hémorragique est suspecté, les transfusions sanguines constituent le liquide de réanimation optimal. Pour ce faire, il est préférable d'utiliser au moins deux cathéters IV de calibre 16-18 et de se fier aux seuils de transfusions suivants [1][3] :
Dans le cas où les produits sanguins ne sont pas accessibles, plusieurs incertitudes persistent quant au type de soluté ainsi que le débit à administrer [2]. Par contre, dans le cas des hémorragies variqueuses, une réplétion volémique trop agressive devrait être évitée, car elle peut augmenter la pression portale[20]. De plus, il est possible de débuter un protocole de transfusion massive selon la réponse aux transfusions initiales. |
| Inhibiteurs de la pompe à protons | Les inhibiteurs de la pompe à protons (IPP) sont utilisés pour traiter les patients atteints d'HDH non variqueuses[1].
Cependant, la littérature actuelle n'a pas trouvé de différence significative entre l'administration d'IPP PO et d'IPP IV post-OGD [21]. Ainsi, la voie d'administration est davantage déterminée en fonction de la disponibilité et des coûts engendrés[21]. L'AGA-CAG recommande l'utilisation d'IPP chez les patients connus pour un saignement ulcéreux et qui prennent des antiplaquettaires ou des anticoagulants en prophylaxie cardiovasculaire. [2] |
| Vasoconstricteur |
|
| Endoscopie gastro-oesophagienne |
|
| Antibiotiques |
|
| Érythromycine |
|
| Acide tranexamique |
|
| Hospitalisation |
|
| Intubation endotrachéale |
|
Deuxième ligne
En ce qui concerne les saignements non variqueux, les modalités complémentaires comprennent :
- l'angiographie
- la chirurgie qui comporte les indications suivantes :
- HDH instable et > 6 unités de transfusions
- réfractaire au traitement endoscopique
- récidive malgré le deuxième traitement endoscopique
- récidive et le patient est en choc
- saignement continu (> 3 culots/jours).
En ce qui concerne les saignements variqueux, les interventions supplémentaires comprennent :
- les mesures permettant de contrôler le saignement en aigu :
- la tamponnade par ballon (ne devrait pas rester en place > 24h)[20]
- le tube de Sengstaken-Blackemore[3]
- les modalités définitives incluent une intervention endoscopique subséquente, un TIPS ou une chirurgie, le tout, en fonction des ressources et de l'expertise disponibles[3].
Suivi
Le saignement cessera spontanément chez 80% des patients[5].
Complications
Les complications:
- choc hémorragique et ses conséquences sur l'hémodynamie
- anémie ferriprive à plus long terme
- encéphalopathie hépatique chez les patients cirrhotiques.
Notes
- ↑ Un méléna représente généralement un saignement important, car il faut au moins 150 ml de sang pour colorer les selles en noir.
- ↑ En prophylaxie de la péritonite bactérienne spontanée.
Références
- Cette page a été modifiée ou créée le 2020/11/07 à partir de Upper Gastrointestinal Bleeding (StatPearls / Upper Gastrointestinal Bleeding (2020/07/21)), écrite par les contributeurs de StatPearls et partagée sous la licence CC-BY 4.0 international (jusqu'au 2022-12-08). Le contenu original est disponible à https://www.ncbi.nlm.nih.gov/pubmed/29262121 (livre).
- Cet article a été créé en partie ou en totalité le 2020/12/07 à partir de Chirurgie (application), créée par Dre Hélène Milot, Dr Olivier Mailloux et collaborateurs et partagé sous la licence CC-BY-SA 4.0 international
- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 1,11 1,12 1,13 1,14 et 1,15 (en) « Chirurgie », sur App Store (consulté le 7 décembre 2020)
- ↑ 2,00 2,01 2,02 2,03 2,04 2,05 2,06 2,07 2,08 2,09 2,10 et 2,11 (en) Alan N. Barkun, Majid Almadi, Ernst J. Kuipers et Loren Laine, « Management of Nonvariceal Upper Gastrointestinal Bleeding: Guideline Recommendations From the International Consensus Group », Annals of Internal Medicine, vol. 171, no 11, , p. 805 (ISSN 0003-4819, PMID 31634917, Central PMCID PMC7233308, DOI 10.7326/M19-1795, lire en ligne)
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 3,7 3,8 et 3,9 (en) Dhiraj Tripathi, Adrian J Stanley, Peter C Hayes et David Patch, « UK guidelines on the management of variceal haemorrhage in cirrhotic patients », Gut, vol. 64, no 11, , p. 1680–1704 (ISSN 0017-5749 et 1468-3288, PMID 25887380, Central PMCID PMC4680175, DOI 10.1136/gutjnl-2015-309262, lire en ligne)
- ↑ Catiele Antunes et Eddie L. Copelin II, StatPearls, StatPearls Publishing, (PMID 29262121, lire en ligne)
- ↑ 5,0 5,1 et 5,2 (en-US) « Overview of GI Bleeding - Gastrointestinal Disorders - Merck Manuals Professional Edition », Merck Manuals Professional Edition, (lire en ligne)
- ↑ Catiele Antunes et Eddie L. Copelin II, StatPearls, StatPearls Publishing, (PMID 29262121, lire en ligne)
- ↑ « Connexion nécessaire — Wikimedica », sur wikimedi.ca (consulté le 13 février 2019)
- ↑ « Lanthier », sur app.lanthiermed.com (consulté le 17 décembre 2020)
- ↑ 9,0 9,1 et 9,2 « UpToDate », sur www.uptodate.com (consulté le 7 décembre 2020)
- ↑ « Revue générale des hémorragies gastro-intestinales - Troubles gastro-intestinaux », sur Édition professionnelle du Manuel MSD (consulté le 9 décembre 2020)
- ↑ Lena Mocker, Ralf Hildenbrand, Tsuneo Oyama et Bernd Sido, « Implementation of endoscopic submucosal dissection for early upper gastrointestinal tract cancer after primary experience in colorectal endoscopic submucosal dissection », Endoscopy International Open, vol. 7, no 4, , E446–E451 (ISSN 2364-3722, PMID 30931376, Central PMCID 6428673, DOI 10.1055/a-0854-3610, lire en ligne)
- ↑ Chinese Journal of Internal Medicine, National Medical Journal of China, Chinese Journal of Digestion et Chinese Journal of Digestive Endoscopy, « [Guidelines for the diagnosis and treatment of acute non-variceal upper gastrointestinal bleeding (2018, Hangzhou)] », Zhonghua Nei Ke Za Zhi, vol. 58, no 3, , p. 173–180 (ISSN 0578-1426, PMID 30803174, DOI 10.3760/cma.j.issn.0578-1426.2019.03.005, lire en ligne)
- ↑ Y. Bai et Z. S. Li, « [Standardize the diagnosis and treatment of acute non-variceal upper gastrointestinal bleeding based on the update guidelines] », Zhonghua Nei Ke Za Zhi, vol. 58, no 3, , p. 161–163 (ISSN 0578-1426, PMID 30803170, DOI 10.3760/cma.j.issn.0578-1426.2019.03.001, lire en ligne)
- ↑ 14,0 14,1 14,2 et 14,3 Catiele Antunes et Eddie L. Copelin II, StatPearls, StatPearls Publishing, (PMID 29262121, lire en ligne)
- ↑ 15,0 et 15,1 (en) Stamatis Karakonstantis, Emmanouil Tzagkarakis, Dimitra Kalemaki et Charalampos Lydakis, « Nasogastric aspiration/lavage in patients with gastrointestinal bleeding: a review of the evidence », Expert Review of Gastroenterology & Hepatology, vol. 12, no 1, , p. 63–72 (ISSN 1747-4124 et 1747-4132, DOI 10.1080/17474124.2018.1398646, lire en ligne)
- ↑ (en-US) Loren Laine et Dennis M Jensen, « Management of Patients With Ulcer Bleeding », American Journal of Gastroenterology, vol. 107, no 3, , p. 345–360 (ISSN 0002-9270, DOI 10.1038/ajg.2011.480, lire en ligne)
- ↑ (en) Daniel J. Pallin et John R. Saltzman, « Is nasogastric tube lavage in patients with acute upper GI bleeding indicated or antiquated? », Gastrointestinal Endoscopy, vol. 74, no 5, , p. 981–984 (ISSN 0016-5107, DOI 10.1016/j.gie.2011.07.007, lire en ligne)
- ↑ (en) Hyasinta Jaka, Mheta Koy, Anthony Liwa et Rodrick Kabangila, « A Fibreoptic endoscopic study of upper gastrointestinal bleeding at Bugando Medical Centre in northwestern Tanzania: A retrospective review of 240 cases », BMC Research Notes, vol. 5, no 1, , p. 200 (ISSN 1756-0500, DOI 10.1186/1756-0500-5-200, lire en ligne)
- ↑ « Physiopathologie et sous classification des différents types de choc : Choc hypovolémique : Sous classification », sur Modules complémentaires en anesthésiologie, Université Laval
- ↑ 20,0 20,1 20,2 et 20,3 Joo Ha Hwang, Amandeep K. Shergill, Ruben D. Acosta et Vinay Chandrasekhara, « The role of endoscopy in the management of variceal hemorrhage », Gastrointestinal Endoscopy, vol. 80, no 2, , p. 221–227 (ISSN 0016-5107, DOI 10.1016/j.gie.2013.07.023, lire en ligne)
- ↑ 21,0 et 21,1 (en) Adrian J Stanley et Loren Laine, « Management of acute upper gastrointestinal bleeding », BMJ, , l536 (ISSN 0959-8138 et 1756-1833, DOI 10.1136/bmj.l536, lire en ligne)
