« Gastrectomie pariétale » : différence entre les versions
m (Antoine Mercier-Linteau a déplacé la page Utilisateur:Hélène Milot/Brouillons/Gastrectomie pariétale vers Utilisateur:Nanxin Jiang/Brouillons/Gastrectomie pariétale) |
|||
| Ligne 21 : | Ligne 21 : | ||
* augmentation du risque de reflux gastro-oesophagien (5-10%)<ref name=":1" /> | * augmentation du risque de reflux gastro-oesophagien (5-10%)<ref name=":1" /> | ||
== Indications | == Indications et contre-indications == | ||
Les indications, ainsi que les contre-indications absolues et relatives de la gastrectomie pariétales sont les critères usuels d'une [[Chirurgie bariatrique|candidature bariatrique]]'''.''' | |||
== Évaluation == | == Évaluation == | ||
L'évaluation bariatrique est multidisciplinaire. La sélection des patients a été établie pour minimiser les complications chirurgicales et maximiser les bénéfices d'une ressource limitée. L'évaluation devrait donc statuer sur la santé mentale, médicale, nutritionnelle et optimiser les comorbidités pour diminuer les complications | L'évaluation [[Chirurgie bariatrique|bariatrique]] est multidisciplinaire. La sélection des patients a été établie pour minimiser les complications chirurgicales et maximiser les bénéfices d'une ressource limitée. L'évaluation devrait donc statuer sur la santé mentale, médicale, nutritionnelle et optimiser les comorbidités pour diminuer les complications. | ||
== Anatomie == | == Anatomie == | ||
| Ligne 165 : | Ligne 96 : | ||
=== Placement de la bougie === | === Placement de la bougie === | ||
Une bougie orogastrique de 32 à 40 Fr est placée sous visualisation laparoscopique. L'anesthésiste pousse la bougie jusqu'au pylore de sorte que l'on mette légèrement en tension la zone pré-pylorique où les dernières attaches épiploïques ont été divisées. | Une bougie orogastrique de 32 à 40 Fr est placée sous visualisation laparoscopique. L'anesthésiste pousse la bougie jusqu'au pylore de sorte que l'on mette légèrement en tension la zone pré-pylorique où les dernières attaches épiploïques ont été divisées. | ||
* '''Taille de la bougie''' : la bougie sert de guide pour l'application des cartouches d'autosuture pour créer un manchon autour de la bougie. Une bougie trop petite créé une gastrectomie trop étroite et donc augmente la résistance et la pression intra-luminale. Ceci augmenterait le risque de fuite. A contrario, une bougie trop large créerait un réservoir trop flasque et la perte de poids ne serait pas optimale. Lors de la cinquième conférence internationale, il a été recommandé d'utiliser une grande bougie (la '''médiane était de 36 Fr''') .<ref name=":11">{{Citation d'un article|prénom1=Michel|nom1=Gagner|prénom2=Colleen|nom2=Hutchinson|prénom3=Raul|nom3=Rosenthal|titre=Fifth International Consensus Conference: current status of sleeve gastrectomy|périodique=Surgery for Obesity and Related Diseases: Official Journal of the American Society for Bariatric Surgery|volume=12|numéro=4|date=2016-05|issn=1878-7533|pmid=27178618|doi=10.1016/j.soard.2016.01.022|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/27178618/|consulté le=2020-11-26|pages=750–756}}</ref> | * '''Taille de la bougie''' : la bougie sert de guide pour l'application des cartouches d'autosuture pour créer un manchon autour de la bougie. Une bougie trop petite créé une gastrectomie trop étroite et donc augmente la résistance et la pression intra-luminale. Ceci augmenterait le risque de fuite. A contrario, une bougie trop large créerait un réservoir trop flasque et la perte de poids ne serait pas optimale. Lors de la cinquième conférence internationale, il a été recommandé d'utiliser une grande bougie (la '''médiane était de 36 Fr''') .<ref name=":11">{{Citation d'un article|prénom1=Michel|nom1=Gagner|prénom2=Colleen|nom2=Hutchinson|prénom3=Raul|nom3=Rosenthal|titre=Fifth International Consensus Conference: current status of sleeve gastrectomy|périodique=Surgery for Obesity and Related Diseases: Official Journal of the American Society for Bariatric Surgery|volume=12|numéro=4|date=2016-05|issn=1878-7533|pmid=27178618|doi=10.1016/j.soard.2016.01.022|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/27178618/|consulté le=2020-11-26|pages=750–756}}</ref> | ||
* '''Longueur du pylore''' : il y a débat sur le point de départ de la première charge d'agrafes en terme de distance du pylore. Des distances de 2 à 6 cm sont pratiquées aujourd'hui et la quantité d'antre retenu détermine sa signification clinique. Avec une distance de 2 cm, plus d'antre est réséqué et le reste gastrique est relativement plus petit. Ceci, en théorie, produira une augmentation de la perte de poids excessive mais peut conduire à plus de complications de l'augmentation de la pression intragastrique distale. Des études comparant une distance de 2 cm et une distance de 4 à 6 cm ont montré des résultats mitigés. L'un a montré des résultats égaux en considérant la perte de poids et les complications <ref name=":8">{{Citation d'un article|prénom1=Ahmed|nom1=ElGeidie|prénom2=Mohamed|nom2=ElHemaly|prénom3=Emad|nom3=Hamdy|prénom4=Mohamed|nom4=El Sorogy|titre=The effect of residual gastric antrum size on the outcome of laparoscopic sleeve gastrectomy: a prospective randomized trial|périodique=Surgery for Obesity and Related Diseases: Official Journal of the American Society for Bariatric Surgery|volume=11|numéro=5|date=2015-09|issn=1878-7533|pmid=25638594|doi=10.1016/j.soard.2014.12.025|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/25638594/|consulté le=2020-11-27|pages=997–1003}}</ref>, et l'autre a démontré une perte de poids accrue sans augmentation des complications pour la longueur de 2 cm.<ref name=":9">{{Citation d'un article|prénom1=Emad|nom1=Abdallah|prénom2=Ayman|nom2=El Nakeeb|prénom3=Tamer|nom3=Youssef|prénom4=Tamer|nom4=Yousef|titre=Impact of extent of antral resection on surgical outcomes of sleeve gastrectomy for morbid obesity (a prospective randomized study)|périodique=Obesity Surgery|volume=24|numéro=10|date=2014-10|issn=1708-0428|pmid=24728866|doi=10.1007/s11695-014-1242-x|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/24728866/|consulté le=2020-11-27|pages=1587–1594}}</ref> L'opinion de la conférence internationale était de commencer la résection à '''au moins 3 cm du pylore'''. <ref name=":0" /> | * '''Longueur du pylore''' : il y a débat sur le point de départ de la première charge d'agrafes en terme de distance du pylore. Des distances de 2 à 6 cm sont pratiquées aujourd'hui et la quantité d'antre retenu détermine sa signification clinique. Avec une distance de 2 cm, plus d'antre est réséqué et le reste gastrique est relativement plus petit. Ceci, en théorie, produira une augmentation de la perte de poids excessive mais peut conduire à plus de complications de l'augmentation de la pression intragastrique distale. Des études comparant une distance de 2 cm et une distance de 4 à 6 cm ont montré des résultats mitigés. L'un a montré des résultats égaux en considérant la perte de poids et les complications <ref name=":8">{{Citation d'un article|prénom1=Ahmed|nom1=ElGeidie|prénom2=Mohamed|nom2=ElHemaly|prénom3=Emad|nom3=Hamdy|prénom4=Mohamed|nom4=El Sorogy|titre=The effect of residual gastric antrum size on the outcome of laparoscopic sleeve gastrectomy: a prospective randomized trial|périodique=Surgery for Obesity and Related Diseases: Official Journal of the American Society for Bariatric Surgery|volume=11|numéro=5|date=2015-09|issn=1878-7533|pmid=25638594|doi=10.1016/j.soard.2014.12.025|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/25638594/|consulté le=2020-11-27|pages=997–1003}}</ref>, et l'autre a démontré une perte de poids accrue sans augmentation des complications pour la longueur de 2 cm.<ref name=":9">{{Citation d'un article|prénom1=Emad|nom1=Abdallah|prénom2=Ayman|nom2=El Nakeeb|prénom3=Tamer|nom3=Youssef|prénom4=Tamer|nom4=Yousef|titre=Impact of extent of antral resection on surgical outcomes of sleeve gastrectomy for morbid obesity (a prospective randomized study)|périodique=Obesity Surgery|volume=24|numéro=10|date=2014-10|issn=1708-0428|pmid=24728866|doi=10.1007/s11695-014-1242-x|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/24728866/|consulté le=2020-11-27|pages=1587–1594}}</ref> L'opinion de la conférence internationale était de commencer la résection à '''au moins 3 cm du pylore'''. <ref name=":0" /> | ||
| Ligne 308 : | Ligne 239 : | ||
== Suivi == | == Suivi == | ||
Le suivi du patient bariatrique est la pierre angulaire du succès à long terme. Les lignes directrices canadiennes<ref name=":12" /> suggèrent : | Le suivi du patient bariatrique est la pierre angulaire du succès à long terme. Les lignes directrices canadiennes<ref name=":12">{{Citation d'un lien web|langue=en-US|nom1=Pearce|prénom1=Nicole|titre=Canadian Adult Clinical Practice Guideline Chapters|url=https://obesitycanada.ca/guidelines/chapters/|site=Obesity Canada|consulté le=2020-11-11}}</ref> suggèrent : | ||
=== Alimentation post-opératoire === | === Alimentation post-opératoire === | ||
Version du 4 avril 2022 à 20:53
| Procédure | |
| Procédure | |
|---|---|
| Système | Digestif |
| Informations | |
| Autres noms | gastrectomie verticale, gastrectomie en manchon |
| Spécialités | Chirurgie générale, endocrinologie, gastro-entérologie |
|
| |
La gastrectomie pariétale (ou verticale) est une intervention bariatrique qui consiste à retirer de façon longiligne le fundus et les portions latérales gauches du corps et de l'antre gastrique ; laissant un volume résiduel d'environ 100 mL le long de la petite courbure gastrique [1]. Ainsi, il s'agit d'une intervention bariatrique dit restrictive, mais également métabolique par les changements neurohormonaux imputables au retrait des cellules pariétales gastriques[1]. La perte de poids attendue est d'environ 25%.[1]
La gastrectomie pariétale, l'une des chirurgies bariatriques les plus populaires de l'ère moderne, a été réalisée pour la première fois en 1990 comme la première portion d'une opération en deux étapes pour la dérivation biliopancréatique avec switch duodénal (BPD-DS)[2]. La première gastrectomie pariétale laparoscopique a été réalisée en 1999. L'indication initiale d'une gastrectomie verticale était chez les patients présentant une super obésité (IMC> 60) pour induire une perte de poids afin de subir plus en toute sécurité la deuxième étape BPD-DS.[3] En suivant ces patients, il a été noté qu'ils avaient d'excellentes réductions de l'excès de poids corporel et en 2008, les indications de la gastrectomie laparoscopique (LSG) ont été publiées.[4] Par rapport à d'autres chirurgies de perte de poids, la gastrectomie pariétale est techniquement plus facile avec relativement moins de morbidité et est donc devenue la chirurgie de perte de poids la plus courante pratiquée aux États-Unis. [5] Actuellement, il y a 3 gastrectomies pour un Y-de-Roux aux États-Unis[1].
Globalement, on retient les avantages suivants pour la gastrectomie verticale[1] :
- intervention de courte durée
- faible morbidité
- profil d'effets secondaires faible
- bonne qualité de vie
Les limitations de la gastrectomie sont toutefois les suivants :
- moins de perte de poids que les autres procédures
- moins de correction des comorbidités métaboliques que les autres procédures
- augmentation du risque de reflux gastro-oesophagien (5-10%)[1]
Indications et contre-indications
Les indications, ainsi que les contre-indications absolues et relatives de la gastrectomie pariétales sont les critères usuels d'une candidature bariatrique.
Évaluation
L'évaluation bariatrique est multidisciplinaire. La sélection des patients a été établie pour minimiser les complications chirurgicales et maximiser les bénéfices d'une ressource limitée. L'évaluation devrait donc statuer sur la santé mentale, médicale, nutritionnelle et optimiser les comorbidités pour diminuer les complications.
Anatomie

Afin de comprendre la procédure de la gastrectomie pariétale, vous devez comprendre l'anatomie de l'estomac, ses structures environnantes et le vaste apport sanguin provenant de l'artère mésentérique supérieure et du tronc coeliaque.[5] L'estomac est divisé en cardia (juste distal à la jonction GE), le fundus (attenant au diaphragme gauche), le corps, l'antre et le pylore. La petite courbure se trouve sous les segments médiaux du foie et comprend l'incisura angularis qui peut être identifiée comme la jonction des axes vertical et horizontal de la petite courbure. La grande courbure est le long bord latéral gauche de l'estomac et supporte l'épiploon. Le bord gauche de l'œsophage intra-abdominal et le fundus se rencontrent à un angle aigu appelé «angle de His». Postérieurement à l'estomac se trouve l'arriète-cavité qui est un espace potentiel antérieur au pancréas et bordé par l'artère splénique, la rate, le rein gauche et le mésocôlon transverse.[5][6]
Ligaments[5]
- Ligament gastro-hépatique - petite courbure vers le bord médial du foie, contient les artères gastriques gauche et droite. Peut contenir une artère hépatique gauche récurrente [5]
- Ligament gastrophrénique - du fundus vers hémidiaphragme gauche[5]
- Ligament gastrosplénique - grande courbure de la rate et contient les vaisseaux gastriques courts [5]
- Ligament gastro-colique - estomac inférieur au côlon transverse, considéré comme faisant partie du grand épiploon et contenant les vaisseaux gastro-épiploïques [5]
Vascularisation[5]

Le tronc coeliaque a trois branches : artères gastrique gauche, hépatique commune et splénique. L'artère gastrique gauche longe la petite courbure supérieure et s'anastomose avec l'artère gastrique droite. L'artère gastrique gauche est le principal apport sanguin à l'estomac après une gastrectomie verticale et elle dégage de nombreuses branches postérieures qui doivent rester ininterrompues pendant la dissection de la surface postérieure de l'estomac. L'artère hépatique commune donne l'artère gastroduodénale qui passe derrière la première partie du duodénum. L'artère gastrique droite est une branche de l'artère hépatique propre et rejoint l'artère gastrique gauche le long de la petite courbure. L'artère gastro-épiploïque droite se branche ensuite à partir de l'artère gastroduodénale et passe dans le ligament gastrocolique (épiploon) le long de la grande courbure pour rejoindre l'artère gastroépiploïque gauche qui est une branche de l'artère splénique courant le long de la plus grande courbure de latéral à médial. L'artère splénique dégage également 3 à 5 artères gastriques courtes circulant dans le ligament gastrosplénique vers le fundus gastrique.[5]
Fonctionnement
La gastrectomie verticale est une chirurgie pour contrer l'obésité par différents mécanismes. D'abord, il s'agit d'une procédure restrictive puisque le volume gastrique est diminué significativement. Le patient aura un volume post-opératoire d'environ 100 mL (½ tasse), puis environ 250 mL à deux ans post-opératoire. Il y a également une composante neurohormonale. La vidange gastrique est accélérée par un relâchement plus précoce de la GLP-1 et de la PYY3-36 (un sous-type de neuropeptide Y très orexigène). Le bolus alimentaire arrivant plus rapidement dans l'intestin, la satiété est obtenue plus rapidement par rétroaction négative. L'estomac amputé de son fundus et de la majorité de son corps sécrète moins de ghreline gastrique - hormone orexigène sécrétée par les cellules pariétales du fundus et du corps gastrique et donc le patient a moins d'appétit globalement.
Préparation
Le patient aura une préparation minutieuse par l'équipe multidisciplinaire. D'abord, tel que discuté ci-haut, plusieurs patients bénéficieront d'un régime faible en calories et élevés en protéines afin de diminuer le volume hépatique pour favoriser une exposition de l'estomac. Le patient recevra une antibioprophylaxie (ex. : céfazoline 2 ou 3g) pondérée selon son poids. Finalement, le patient doit recevoir une thromboprophylaxie ajustée à son poids sous forme d'héparine sous-cutanée et on lui installera des jambières à compression séquentielle.
Le patient sera placé en décubitus dorsal. Selon la préférence du chirurgien, il sera les jambes fermées ou écartées (split-leg). L'opérateur principal sera à droite ou entre les jambes. L'assistant se placera à gauche du patient.
Après l'induction anesthésique, on placera le patient en Fowler (Tredelenburg inversé). Une sonde orogastrique pour décomprimée l'estomac sera installée puis retirée avant la manipulation de celui-ci par le chirurgien.
Équipement
L'équipement laparoscopique de base est nécessaire pour cette opération qui comprendra l'insufflation avec du gaz CO2, des champs chirurgicaux, des moniteurs, des instruments laparoscopiques, l'électrocautérisation et des trocarts. Contrairement aux procédures laparoscopiques conventionnelles, avec les patients bariatriques, vous aurez besoin de trocarts plus longs ainsi que d'instruments laparoscopiques plus longs pour s'adapter à la paroi abdominale plus épaisse.[5]
Sont également requis: [5]
- 3 trocarts de 5 mm pour les instruments et l'écarteur hépatique, 1 trocart Optiview pour le laparoscope (10-12 mm), 1 ou 2 trocarts de 12 mm pour l'agrafeuse
- 1 aiguille de Veress standard ou extra-longue
- écarteur hépatique (ex. : écarteur de Nathanson)
- laparoscope 30 degrés, lentille 5 ou 10 mm
- agrafeuse linéaire endoscopique avec différentes épaisseurs de cartouche (en moyenne 5 à 6 applications)
- bougie de 34 Fr (selon la préférence du chirurgien)
- endoscope flexible au besoin
- dispositif d'énergie laparoscopique
- porte-aiguille laparoscopique
- clippeuse vasculaire
- sutures à peau
- un sac endoscopique pour l'extraction de l'estomac
Technique
Il existe de nombreuses façons d'effectuer une gastrectomie laparoscopique en manchon, et une procédure type est présentée ici.
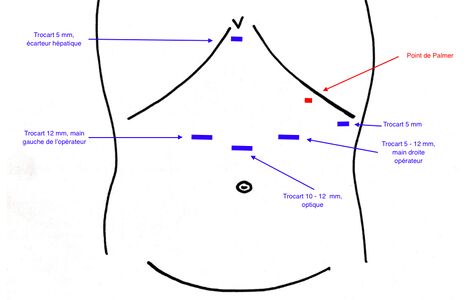
Entrée et mise en place
L'entrée dans l'abdomen commence dans le quadrant supérieur gauche (point de Palmer) et la technique utilisée est à la discrétion du chirurgien. Habituellement, l'aiguille de Veress est utilisée puis le trocart Optiview est introduit avec le laparoscope. L'abdomen est insufflé à une pression de 15 mmHg et l'abdomen est exploré visuellement avec un laparoscope. Un pneumopéritoine de 12 mmHg a été proposé dans les protocoles ERAS, mais le patient doit être fortement curarisé. Le placement du trocart sera le suivant:
- Trocart de 5 mm dans le quadrant supérieur gauche, ligne axillaire antérieure (port de l'assistant)
- Trocart de 5 ou 12 mm dans la ligne médio-claviculaire supérieure gauche pour la main droite du chirurgien
- Trocart de 5 ou 12 mm dans la ligne médio-claviculaire paramédiane supérieure droite pour la main gauche du chirurgien
- Trocart de 12 mm placé au niveau ou juste au-dessus de l'ombilic (habituellement une longueur de main sous l'apophyse xyphoïde) poir la caméra
- Écarteur de foie placé dans la zone sous-xiphoïde via un trocart 5 mm. L'écarteur Nathanson est habituellement utilisé.
- Une fois tous les ports insérés et le foie rétracté, le patient est placé en Trendelenburg inversé, le patient est en split-leg et donc le chirurgien est entre les jambes du patient, l'assistant est à gauche de celui-ci.
Mobilisation de la grande courbure
La dissection commence par la division de l'épiploon à quelques centimètres en amont du pylore. On divise l'épiploon en tentant de préserver le plus possible sa vascularisation en utilisant un appareil d'électrochirurgie. On monte le long de la grande courbure jusqu'à rencontrer les vaisseaux courts du pôle supérieur de la rate. D'ailleurs, celui-ci peut devenir ischémique (bleuté) en cours de procédure car la rate a une circulation terminale. La dissection est poursuivie pour diviser complètement le ligament gastrophrénique jusqu'à mobiliser l'angle de His. On doit bien voir le pilier gauche du diaphragme.
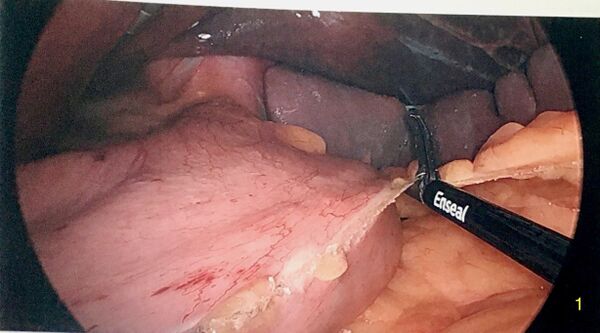
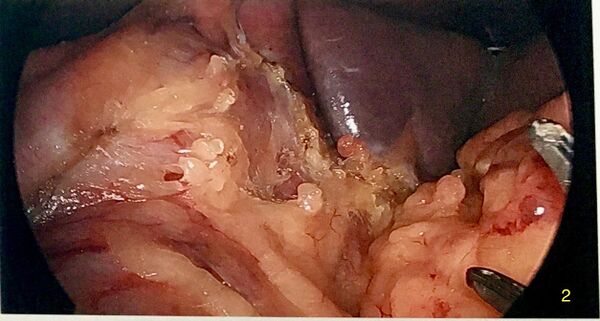
Identification et réparation d'une hernie hiatale
Après avoir exposé le pilier gauche du diaphragme, on doit évaluer s'il y a une hernie hiatale. Si tel est le cas, il est recommandé d'en réduire le contenu et le sac et de réparer la hernie avec un rapprochement des piliers. On utilise des sutures en X interrompues en arrière de l'oesophage.
Mobilisation postérieure
L'épiploon étant séparé complètement de la grande courbure, on accède à l'arrière-cavité des épiploons. L'estomac est soulevé antérieurement pour exposer sa paroi postérieure. Toutes les adhérences doivent être défaites, en prenant soin de ne pas transmettre de chaleur de l'appareil d'électrochirurgie sur la capsule pancréatique. On doit visualiser la petite courbure. La vascularisation de celle-ci servira de point de repère pour l'application des recharges de l'agrafeuse.
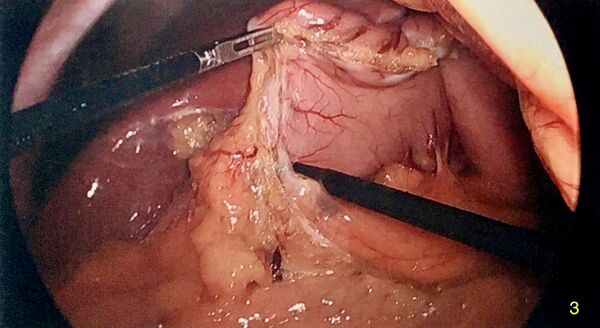
Placement de la bougie
Une bougie orogastrique de 32 à 40 Fr est placée sous visualisation laparoscopique. L'anesthésiste pousse la bougie jusqu'au pylore de sorte que l'on mette légèrement en tension la zone pré-pylorique où les dernières attaches épiploïques ont été divisées.
- Taille de la bougie : la bougie sert de guide pour l'application des cartouches d'autosuture pour créer un manchon autour de la bougie. Une bougie trop petite créé une gastrectomie trop étroite et donc augmente la résistance et la pression intra-luminale. Ceci augmenterait le risque de fuite. A contrario, une bougie trop large créerait un réservoir trop flasque et la perte de poids ne serait pas optimale. Lors de la cinquième conférence internationale, il a été recommandé d'utiliser une grande bougie (la médiane était de 36 Fr) .[7]
- Longueur du pylore : il y a débat sur le point de départ de la première charge d'agrafes en terme de distance du pylore. Des distances de 2 à 6 cm sont pratiquées aujourd'hui et la quantité d'antre retenu détermine sa signification clinique. Avec une distance de 2 cm, plus d'antre est réséqué et le reste gastrique est relativement plus petit. Ceci, en théorie, produira une augmentation de la perte de poids excessive mais peut conduire à plus de complications de l'augmentation de la pression intragastrique distale. Des études comparant une distance de 2 cm et une distance de 4 à 6 cm ont montré des résultats mitigés. L'un a montré des résultats égaux en considérant la perte de poids et les complications [8], et l'autre a démontré une perte de poids accrue sans augmentation des complications pour la longueur de 2 cm.[9] L'opinion de la conférence internationale était de commencer la résection à au moins 3 cm du pylore. [5]
Résection gastrique
Une agrafeuse endoscopique de 60 mm de long est utilisée pour suturer et trancher l'estomac dans son axe vertical. La mise à feu est commencée à environ 5 cm proximal au pylore le long de la bougie et avec un angle parallèle à la petite courbure. Il faut s'assurer que l'agrafeuse englobe des longueurs égales de l'estomac antérieur et postérieur pour éviter la «spirale» du manchon - la mise en tension de la grande courbure par l'assistant est essentielle pour ce faire. Les lignes d'agrafes sont tirées séquentiellement le long de la bougie vers l'angle de His. En moyenne, l'épaisseur de paroi de l'antre, du corps et des fonds est respectivement de 3,1, 2,4 et 1,7 mm [10] Le but est d'utiliser une agrafeuse avec des agrafes suffisamment hautes pour accueillir l'antre le plus épais par opposition au fond de l'œil plus fin . Certains ont préconisé des résultats supérieurs en utilisant une hauteur d'agrafe plus haute en distal et une hauteur d'agrafe plus courte en proximal à l'approche du fundus.[11] On utilise des agrafes de plus en plus petites (exemples avec Echelon, on utilise d'abord des agrafes noires ou vertes, puis dorées, et finalement bleues). De 5 à 6 applications sont nécessaires.
Il ne doit plus rester de cardia à la dernière application de cartouche.
- Renforcement de la ligne d'agrafage - les principaux objectifs du renforcement de la ligne d'agrafage sont de réduire les taux de fuite et d'hémorragie de la ligne d'agrafage. Il existe de nombreuses techniques pour ce faire et se divisent en deux catégories principales, la surpiqûre (clips endoscopiques ou surjet de Maxon) et le renforcement. Dans une méta-analyse récente en 2016, en comparant le renforcement à l'absence de renforcement, il n'y avait pas de différence statistiquement significative dans le taux de fuite, mais il a montré une diminution des complications globales, y compris le saignement de la ligne d'agrafage. Lors de la comparaison entre le surjet et le renforcement, le surjet a révélé des avantages plus faibles avec des temps de fonctionnement plus longs et un taux de complications plus élevé ; mais est moins coûteuse. Néanmoins, le concensus jusqu'à ce jour est d'utiliser une technique ou l'autre, afin de diminuer le risque de saignement.
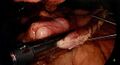
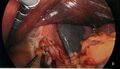
-
Application de la première cartouche d’autosutures, bougie 34 Fr en place.
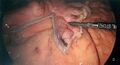
-
Visualisation de la première application d’agrafes.
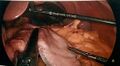
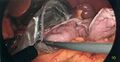
-
Application d’une deuxième cartouche d’autosutures. Le foie toujours surélevé.
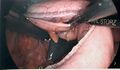
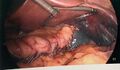
-
Application de la 5e et dernière cartouches d’autosutures. On regarde sous l’estomac pour bien visualiser le pilier gauche du diaphragme (à gauche de l’image). On entrevoit la rate qui est ischémique en son pôle supérieur (après la division des vaisseaux courts).
-
On renforce la ligne d’agrafes avec des clips endoscopiques après avoir retiré la bougie.
Endoscopie
Cette étape est optionnelle. Elle est suggérée lors des reprises de gastrectomie verticale ou si on a un doute sur l'intégrité de la ligne d'agrafe. Un endoscope flexible est soigneusement inséré dans l'œsophage et la ligne d'agrafage est visualisée pour l'intégrité et l'hémostase. L'estomac restant peut être immergé dans le liquide d'irrigation, puis insufflé avec l'endoscope pour rechercher une fuite. Il est aussi possible d'instiller une solution colorée par du bleu de méthylène.
- Test de fuite peropératoire - ceci est à la discrétion du chirurgien car il a eu des résultats incohérents. Une analyse rétrospective multicentrique en 2017 a démontré une faible sensibilité du test de fuite peropératoire pour prédire les fuites postopératoires. Ils ont démontré que le test de fuite peropératoire était négatif chez 91% des patients qui ont finalement développé une fuite de la ligne d'agrafes.[12]
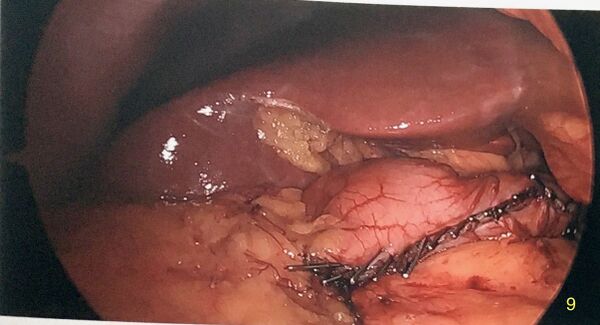
Retrait de l'estomac
L'estomac est mis dans un sac endoscopique afin de diminuer la contamination de la paroi du trou de trocart qui servira de site d'extraction. Habituellement, on utilise le site de trocart de 12 mm paramédian droit.
-
On met l’estomac excisé dans un sac endoscopique et on le retire par le site de trocart de travail qu’on agrandit. On refermera l’aponévrose de celui-ci ensuite.
-
Dernier regard sur le site chirurgical. Pôle supérieur de la rate clairement ischémique. Hémostase adéquate. On retire l’écarteur hépatique sous vision directe. Il y a une hépatomégalie du foie gauche secondaire à la stéatose.
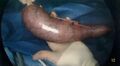
-
Estomac retiré dans lequel on a insufflé du CO2 pour visualiser la ligne d’agrafes (absence de torsion).
Fermeture
Une fermeture aponévrotique avec un passe-fil est effectuée sur le site du port de travail élargi pour l'extraction et la fermeture cutanée est effectuée sur tous les sites.
Complications
Toute contribution serait appréciée.
| Description: | Section dans laquelle on décrit l'ensemble des complications pouvant survenir après le traitement et la prise en charge sommaire de cette complication. Si la description des complications ou de leur traitement est trop longue, il est préférable de faire une page de situation clinique ou de maladie distincte et d'insérer un hyperlien sur la page de traitement. Les éléments de cette section sont définis avec des propriétés de type Complication. |
| Formats: | Liste à puces |
| Balises sémantiques: | Complication |
| Commentaires: | |
| Exemple: | |
Complications After Laparoscopic Sleeve Gastrectomy
| CRITERIA | HUTTER | BIRKMEYER | CARLIN | INGE |
|---|---|---|---|---|
| No. of patients | 944 | 854 | 2949 | 67 |
| Age (years) | Mean = 47 | 37-55 | Mean = 46 | 13-19 |
| Mortality | 0.11 | 0 | 0.07 | 0 |
| Leak perforation | 0.74 | 0.35 | 0.9 | 1.5 |
| Surgical site infection | 2.0 | 2.2 | 2.2 | 3 |
| Pulmonary embolus/venous thromboembolism | 0.32 | 0.9 | 0.5 | 0 |
| Reoperation | 3.0 | 0.6 | 1.4 | 1.5 |
| Bleeding | 0.6 | 0.6 | 1.1 | 0 |
Actuellement, la morbidité et la mortalité à 30 jours d'une gastrectomie en manchon laparoscopique dans la littérature varient respectivement de 0 à 17,5% et de 0 à 1,2 %.[13] [5]
Comme pour de nombreuses opérations, les complications peuvent être divisées entre précoces et tardives.
Début: [5]
Hémorragie [5]
L'incidence rapportée est comprise entre 1 et 6% en postopératoire et peut être intraluminale ou intraabdominale.[14] Les saignements extraluminaux proviennent généralement de la ligne d'agrafage, de la rate, du foie ou de la paroi abdominale. Ceci est traité avec une réopération à la discrétion du chirurgien. Pour les saignements intraluminaux, le patient peut présenter une méléna ou une hématémèse avec une goutte d'hématocrite concomitante. Cela peut être traité par des moyens endoscopiques et plus rarement une intervention chirurgicale. [5]
Il existe des preuves pour soutenir le renforcement de la ligne d'agrafage pour éviter les saignements. Il y a eu plus de succès lors de la comparaison des matériaux de contrefort par opposition au renforcement des sutures de ligne d'agrafes. Il y a encore une controverse dans ce domaine, et une conclusion définitive n'a pas encore été tirée. [15][5]
Fuite [5]
L'incidence des fuites postopératoires lors de la gastrectomie par manchon laparoscopique est comprise entre 2 et 3% .[16] La cause de la fuite chez les patients souffrant de gastrectomie par manchon est une augmentation de la pression relayée sur la ligne d'agrafage en cas d'ischémie relative. Ceci est généralement situé juste en dessous de la jonction GE où il y a une ischémie relative en raison de la dépendance aux vaisseaux gastriques courts sacrifiés. L'augmentation de la pression peut être due à un rétrécissement distal causé par une bougie de petit calibre, un rétrécissement ou une erreur technique de tir de l'agrafeuse trop près de l'incisura angularis. Il y a eu des résultats et des opinions mitigés sur la question de savoir si le renforcement de la ligne d'agrafage peut réduire le taux de fuite postopératoire et des études supplémentaires sont nécessaires. Il a été démontré qu'une plus grande taille de bougie réduira l'incidence des fuites chez les patients souffrant de gastrectomie en manchon.
Les patients peuvent être asymptomatiques mais présentent fréquemment de la fièvre, une tachycardie et une tachypnée, une fréquence cardiaque élevée étant le premier signe. Le test diagnostique de choix est un scanner avec contraste oral et IV qui démontre une sensibilité et une spécificité relativement élevées. Une série de contraste UGI a une spécificité élevée, mais une faible sensibilité et n'est donc pas recommandée comme imagerie diagnostique de première intention. [5]
Les fuites doivent être classées comme aiguë (<5 jours après l'opération) ou chronique (> 4 semaines après l'opération). Chez le patient aigu et instable, l'exploration avec drainage de la fuite et mise en place d'une sonde d'alimentation distale est la gestion de choix. Chez le patient chronique, la prise en charge chirurgicale est moins réussie. S'ils sont instables, le patient nécessitera une opération comme décrit pour une fuite aiguë. Pour une fuite / fistule chronique chez un patient stable, le traitement est conservateur en utilisant le drainage de l'abcès s'il est présent, des antibiotiques, du NPO, du TPN et un stenting endoluminal. La plupart des fistules / fuites chroniques se referment dans la fourchette de 4 semaines à 3 mois.[17][5]
Tardif: [5]
Stricture [5]
Cette complication a une incidence allant jusqu'à 4 pour cent et peut se présenter de manière aiguë secondaire à un œdème ou plus souvent de manière chronique. Les symptômes courants sont la dysphagie, les nausées et les vomissements et la localisation la plus fréquente est l'incisura angularis. Dans le contexte aigu, cela est probablement secondaire à un œdème ou à une torsion due à des problèmes techniques. L'image diagnostique de choix est une étude de contraste UGI. Le traitement de la sténose aiguë est conservateur et ne nécessite une intervention chirurgicale qu'en cas de non-résolution. Les patients qui présentent des sténoses chroniques doivent subir des dilatations endoscopiques du ballon et peuvent nécessiter plusieurs interventions pour une amélioration à long terme. L'échec de la prise en charge endoscopique nécessitera une intervention chirurgicale avec soit une séromyotomie laparoscopique, soit une conversion en une procédure de pontage gastrique.[18][5]
Reflux gastro-œsophagien [5]
Le RGO sévère est une contre-indication relative à la gastrectomie en manchon. Il y a eu des résultats contradictoires dans la littérature, mais beaucoup ont préconisé le développement ou l'aggravation des symptômes de reflux.Les traitements de première intention sont des IPP, mais si le patient présente des symptômes sévères et est réfractaire au traitement médical, ils peuvent nécessiter une conversion en pontage gastrique Roux-en-Y.[19][5]
Carences nutritionnelles [5]
Toutes les procédures bariatriques présentent des carences en nutriments et sont largement évitées par des tests de routine et une supplémentation quotidienne. Il existe des données montrant une diminution de l'incidence de la carence en nutriments par rapport au patient ayant subi un pontage gastrique, à l'exception du folate.
Shackelford :
LSG is associated with a very low incidence of morbidity and mortality. One large database recently reported the incidence of 30-day mortality as 0.1% and serious morbidity as 3.8%. Reoperation rates were 1.6%.
The most common complications that occur after LSG are staple line leaks and staple line bleeding. Staple line bleeding is generally reported in the 1% range, with the use of buttress material decreasing the rate from 1.0% to 0.75%. Staple line leak rate is similarly reported in the 1% range, with buttressing actually potentially increasing the incidence of leakage from 0.65% to 0.96%.
Stenosis of the staple line is the only other major commonly reported complication after LSG. Its incidence is in the 1% to 2% range generally, with reoperation being required if dilation does not produce adequate relief of obstructive symptoms.
Adjustment to the LSG anatomy can, for some patients, be difficult. We have observed a small percentage of patients (4% to 6%) who experience persistent nausea, for a period of up to 3 months after surgery, despite confirmation of no obstructive anatomy postoperatively.
After a patient is more than a few months out from an LSG, the incidence of later complications is relatively low. This is especially true when compared with LRYGB, which has long-term problems of bowel obstruction and marginal ulcers. New-onset GERD may arise after LSG, with an estimated incidence of 8%.
Suivi
Le suivi du patient bariatrique est la pierre angulaire du succès à long terme. Les lignes directrices canadiennes[20] suggèrent :
Alimentation post-opératoire
Il existe différents protocoles alimentaires post-opératoires, mais essentiellement nous retenons d'abord une alimentation liquide, puis molle et finalement solide après environ 2 semaines si les premières étapes sont bien tolérées. Il est recommandé de manger 3 à 5 petits repas par jour en débutant toujours avec les sources de protéines. Les recommandations d'apport en protéines sont de 1.2 à 1.5 g/kg/jr[20]. Il faut manger lentement et bien mastiquer. Il n'est pas recommandé de boire et manger simultanément ; on évite les liquides dans les 30 minutes suivant le repas. De plus, une bonne hydratation est très importante. Les boissons gazeuses sont fortement déconseillées autant pour leur piètre aspect nutritionnel que pour l'inconfort causé par le gaz carbonique.
Changement d'habitudes de vie[20]
- alcool : il n'est pas recommandé de consommer de l'alcool puisqu'il s'agit d'un ulcérogène, d'une source de calories vides et l'effet peut être plus rapide car la vidange gastrique est accélérée. Malheureusement, 7% des patients opérés développeront une dépendance à l'alcool.
- activité physique : il est recommandé de faire 150 - 300 minutes d'activité physique par semaine, ceci permet de stabiliser la perte de poids, augmenter la masse maigre et améliore la santé mentale
- tabagisme : l'absentation de la cigarette est fortement recommandée car le tabac est ulcérogène
- marijuana : la modération est recommandée. Il y a très peu d'études sur le sujet, mais la marijuana est orexigène et donc contrevient aux vertus de la chirurgie bariatrique
Fertilité :
Les femmes opérées en-deçà d'un an de la procédure bariatrique avaient un taux de perte foetale plus élevée contrairement à celles qui attendaient après un an (35.5% vs 16.3%). La grossesse est recommandée après 18 mois post-opératoires. Une contraception doit être proposée pendant la période charnière.[20]
Vitamines et minéraux
Voici les prises vitaminiques suggérées après la procédure selon les lignes directrices de l'ASMBS 2020[21] :
- B1 : minimum 12 mg/jr ; préférablement 50 mg/jr via une multivitamine ou complexe B
- B12 : 350-500 mcg PO/jr ou 1000 mcg IM/mois
- Acide folique : 400-800 mcg PO/jr via une multivitamine (si en âge de procréer : 800-1000 mcg PO/jr)[Note 1]
- Fer élémentaire[Note 2] : minimum 45-60 mg/jr
- Vitamine E : 15 mg/jr
- Citrate de calcium[Note 3] : 1200-1500 mg/jr
- Vitamine D3 : 3000 UI/jr et titrer pour avoir des niveaux sériques > 75 nmol/L
- Vitamine A : 5000-10000 UI/jr
- Vitamine K : 90 - 120 μg/jr
- Zinc : 100% RDA (8-11 mg/jr)
- Cuivre : 100% RDA (1 mg /jr)
Ainsi, à moins d'un déficit documenté en pré-opératoire, une multi-vitamine extra-forte 1 ou 2 comprimés par jour de même qu'un supplément de fer et/ou de vitamine D couvrent les besoins du patient opéré. L'observance diminue dans le temps et des rappels doivent souvent être faits. De plus, les suppléments peuvent occasionner une constipation - effet secondaire également de la gastrectomie pariétale. Pour plus de détails selon la procédure et les comorbidités du patient, vous pouvez consulter les lignes directrices canadiennes : http://obesitycanada.ca/wp-content/uploads/2020/08/14-Table-1-with-links-1.pdf .
Analyses de laboratoires
Voici les analyses de laboratoire recommandées :
Signification clinique
Résultats attendus
Des données à long terme sont maintenant disponibles sur les résultats de la gastrectomie. La perte de poids moyenne en excès («excess weight loss») après cinq ans pour une gastrectomie laparoscopique pariétale serait d'environ 60%, la perte de poids moyenne étant de 25%, et la résolution des comorbidités est excellente. Une méta-analyse réalisée en 2017 a comparé les résultats à mi-parcours et à long terme entre la gastrectomie pariétale et le Y-de-Roux La conclusion était qu'à mi-parcours (3 à 5 ans après l'opération) les deux chirurgies avaient des résultats similaires en termes de perte de poids excessive et de résolution ou d'amélioration des comorbidités. Les données à long terme ont démontré que le bypass gastrique a finalement entraîné une perte de poids supérieure, mais l'amélioration des comorbidités est restée la même entre les deux procédures.[22][5]
Voici un résumé de la résolution[20] des comorbidités associées à l'obésité en fonction de la procédure effectuée[Note 4] :
| Gastrectomie pariétale | Y-de-Roux | Dérivation bilio-pancréatique
avec switch duodénal | |
|---|---|---|---|
| Perte de poids total (%) | 25 | 30 | 40 |
| Taux de résolution du diabète de type 2 | 30 | 40 | 80 |
| Taux de résolution de l'hypertension (%) | 30 | 40 | 60 |
| Taux de résolution de l'apnée/hypopnée du sommeil | 40 | 50 | 70 |
| Taux de résolution du reflux gastro-oesophagien | |||
| Taux de résolution de la dyspilidémie | 65 | 95 |
Reprise de poids
La gastrectomie verticale comme pont vers la dérivation bilio-pancréatique
Sabiston : Because of a high incidence of morbidity and mortality (23% and 7%, respectively) in patients with a BMI greater than 60 kg/m 2 undergoing laparoscopic DS, surgeons developed the two-stage DS, with sleeve gastrectomy alone performed as the first stage to decrease morbidity in this population of superobese patients. The Clinical Issues Committee of the ASMBS performed a comprehensive review of the subject and found 13 studies in 821 high-risk patients undergoing a staged approach with LSG. On average, the preoperative BMI was 60 and, after 4 to 60 months of follow-up, the postoperative BMI was 45. The complications in this population of high-risk patients showed a leak rate of 1.2%, bleeding rate of 1.6%, and mortality of 0.24%. The ASMBS concluded that LSG has value as the initial stage of a bariatric surgery in a high-risk population (
Notes
- ↑ Risque de masquer une déficience en vitamine B12 si dose d’acide folique > 1 mg par jour.
- ↑ Le fer pourrait être pris avec vitamine C pour augmenter l’absorption. Prendre le fer en doses divisées au courant de la journée. Ne pas le prendre en même temps que le calcium et que les IPP.
- ↑ Prendre le calcium en doses divisées de 500 mg au courant de la journée avec ou sans nourriture. Prendre au moins 2h après la prise de multivitamine et de fer. Le citrate de calcium est mieux absorbé que le carbonate de calcium
- ↑ Les résultats de la bande gastrique ne sont pas inclus dans ce tableau puisque cette procédure n'est plus recommandée dans les lignes directrices canadiennes
Références
- Cette page a été modifiée ou créée le 2020/10/25 à partir de Sleeve Gastrectomy (StatPearls / Sleeve Gastrectomy (2020/06/28)), écrite par les contributeurs de StatPearls et partagée sous la licence CC-BY 4.0 international (jusqu'au 2022-12-08). Le contenu original est disponible à https://www.ncbi.nlm.nih.gov/pubmed/30085577 (livre).
- ↑ 1,0 1,1 1,2 1,3 1,4 et 1,5 Reavis, Kevin M.,, Barrett, Allison M.,, Kroh, Matthew, et Society of American Gastrointestinal Endoscopic Surgeons,, The SAGES manual of bariatric surgery (ISBN 978-3-319-71282-6 et 3-319-71282-9, OCLC 1031089500, lire en ligne)
- ↑ Picard Marceau, Simon Biron, Roch-André Bourque et Martin Potvin, « Biliopancreatic Diversion with a New Type of Gastrectomy », Obesity Surgery, vol. 3, no 1, , p. 29–35 (DOI 10.1381/096089293765559728, lire en ligne)
- ↑ Philippe Topart, Guillaume Becouarn et Patrick Ritz, « Should biliopancreatic diversion with duodenal switch be done as single-stage procedure in patients with BMI > or = 50 kg/m2? », Surgery for Obesity and Related Diseases: Official Journal of the American Society for Bariatric Surgery, vol. 6, no 1, , p. 59–63 (ISSN 1878-7533, PMID 19640795, DOI 10.1016/j.soard.2009.04.016, lire en ligne)
- ↑ Drake Eric Bellanger et Frank L. Greenway, « Laparoscopic sleeve gastrectomy, 529 cases without a leak: short-term results and technical considerations », Obesity Surgery, vol. 21, no 2, , p. 146–150 (ISSN 1708-0428, PMID 21132397, DOI 10.1007/s11695-010-0320-y, lire en ligne)
- ↑ 5,00 5,01 5,02 5,03 5,04 5,05 5,06 5,07 5,08 5,09 5,10 5,11 5,12 5,13 5,14 5,15 5,16 5,17 5,18 5,19 5,20 5,21 5,22 5,23 5,24 5,25 5,26 et 5,27 Kevin Seeras, Senthilkumar Sankararaman et Peter P. Lopez, StatPearls, StatPearls Publishing, (PMID 30085577, lire en ligne)
- ↑ Netter. Gastroenterología, Elsevier, (ISBN 978-84-458-1567-0, lire en ligne), p. XXI
- ↑ Michel Gagner, Colleen Hutchinson et Raul Rosenthal, « Fifth International Consensus Conference: current status of sleeve gastrectomy », Surgery for Obesity and Related Diseases: Official Journal of the American Society for Bariatric Surgery, vol. 12, no 4, , p. 750–756 (ISSN 1878-7533, PMID 27178618, DOI 10.1016/j.soard.2016.01.022, lire en ligne)
- ↑ Ahmed ElGeidie, Mohamed ElHemaly, Emad Hamdy et Mohamed El Sorogy, « The effect of residual gastric antrum size on the outcome of laparoscopic sleeve gastrectomy: a prospective randomized trial », Surgery for Obesity and Related Diseases: Official Journal of the American Society for Bariatric Surgery, vol. 11, no 5, , p. 997–1003 (ISSN 1878-7533, PMID 25638594, DOI 10.1016/j.soard.2014.12.025, lire en ligne)
- ↑ Emad Abdallah, Ayman El Nakeeb, Tamer Youssef et Tamer Yousef, « Impact of extent of antral resection on surgical outcomes of sleeve gastrectomy for morbid obesity (a prospective randomized study) », Obesity Surgery, vol. 24, no 10, , p. 1587–1594 (ISSN 1708-0428, PMID 24728866, DOI 10.1007/s11695-014-1242-x, lire en ligne)
- ↑ Hazem Elariny, Hamilton González et Bingshi Wang, « Tissue thickness of human stomach measured on excised gastric specimens from obese patients », Surgical Technology International, vol. 14, , p. 119–124 (ISSN 1090-3941, PMID 16525963, lire en ligne)
- ↑ David L. Warner et Kent C. Sasse, « Technical Details of Laparoscopic Sleeve Gastrectomy Leading to Lowered Leak Rate: Discussion of 1070 Consecutive Cases », Minimally Invasive Surgery, vol. 2017, , p. 4367059 (ISSN 2090-1445, PMID 28761766, Central PMCID 5518516, DOI 10.1155/2017/4367059, lire en ligne)
- ↑ Jason Bingham, Jedediah Kaufman, Kai Hata et James Dickerson, « A multicenter study of routine versus selective intraoperative leak testing for sleeve gastrectomy », Surgery for Obesity and Related Diseases: Official Journal of the American Society for Bariatric Surgery, vol. 13, no 9, , p. 1469–1475 (ISSN 1878-7533, PMID 28629729, DOI 10.1016/j.soard.2017.05.022, lire en ligne)
- ↑ https://www.ncbi.nlm.nih.gov/pubmed/29054173
- ↑ https://www.ncbi.nlm.nih.gov/pubmed/17387557
- ↑ https://www.ncbi.nlm.nih.gov/pubmed/24507083
- ↑ https://www.ncbi.nlm.nih.gov/pubmed/25968078
- ↑ https://www.ncbi.nlm.nih.gov/pubmed/19506979
- ↑ https://www.ncbi.nlm.nih.gov/pubmed/22044967
- ↑ https://www.ncbi.nlm.nih.gov/pubmed/20101473
- ↑ 20,0 20,1 20,2 20,3 et 20,4 (en-US) Nicole Pearce, « Canadian Adult Clinical Practice Guideline Chapters », sur Obesity Canada (consulté le 11 novembre 2020)
- ↑ Shravan Leonard-Murali, Hassan Nasser, Tommy Ivanics et Jeffrey Genaw, « Predictors of postoperative emergency department visits after laparoscopic bariatric surgery », Surgery for Obesity and Related Diseases, vol. 16, no 10, , p. 1483–1489 (ISSN 1550-7289, DOI 10.1016/j.soard.2020.05.023, lire en ligne)
- ↑ Saeed Shoar et Alan A. Saber, « Long-term and midterm outcomes of laparoscopic sleeve gastrectomy versus Roux-en-Y gastric bypass: a systematic review and meta-analysis of comparative studies », Surgery for Obesity and Related Diseases: Official Journal of the American Society for Bariatric Surgery, vol. 13, no 2, , p. 170–180 (ISSN 1878-7533, PMID 27720197, DOI 10.1016/j.soard.2016.08.011, lire en ligne)