Cirrhose hépatique
| Maladie | |||
 | |||
| Caractéristiques | |||
|---|---|---|---|
| Signes | Splénomégalie, Oedème des membres inférieurs, Ecchymoses, Hépatomégalie, Gynécomastie, Ictère , Tachypnée , Érythème palmaire, Distension abdominale , Clubbing, ... [+] | ||
| Symptômes |
Anorexie , Dysfonction érectile, Crampes musculaires, Nausées, Aménorrhée , Oligoménorrhée , Fatigue , Asthénie , Infertilité (approche clinique), Douleur abdominale, ... [+] | ||
| Diagnostic différentiel |
Grossesse, Dialyse péritonéale, Tuberculose, Lymphome, Leucémie, Malaria, Organomégalie, Myélome multiple, Intoxication à l'acétaminophène, Insuffisance cardiaque droite, ... [+] | ||
| Informations | |||
| Terme anglais | Liver cirrhosis | ||
| Autres noms | Cirrhose du foie | ||
| SNOMED CT ID | 19943007 | ||
| Spécialité | Gastro-entérologie | ||
| |||
La cirrhose hépatique se caractérise par la formation de tissu cicatriciel et de nodules dans le foie secondairement à des lésions chroniques. Ceci entraîne une altération de l'organisation lobulaire normale du foie, altérant significativement le métabolisme oxydatif des lipides et des glucides, ainsi que l'élimination de la bile et de l'urée.[1]
Épidémiologie
On estime à environ 1% la prévalence mondiale, et entre 0,15 % et 0,27 % aux États-Unis. En 2018, environ 1 canadien sur 4 possède une maladie du foie chronique, ce qui le met à risque de développer une cirrhose.[2][3]
Seul le tiers des patients porteurs de cirrhose sont au courant[4].
Étiologies
La cirrhose est dû aux étiologies suivantes[1][3][5] :
- le consommation chronique d'alcool (60-70 %)[6]
- les virus hépatotropes (10%[6]) : l'hépatite B, l'hépatite C et l'hépatite D
- les causes métaboliques : l'hémochromatose (5-10 %)[6], la maladie de Wilson, la stéatose hépatique non alcoolique (cirrhose NASH) (10 %) et le déficit en alpha-1-antitrypsine
- les causes auto-immunes : l'hépatite auto-immune et la cirrhose biliaire primitive (CBP)
- les médicaments[7]: l'acétaminophène, le methotrexate, le methyldopa, l'isoniazide et l'amiodarone,
- les causes biliaires[7][8] (5-10%[6]): les cholédocholithiases, la cholangite sclérosante primitive (CSP), la pancréatite chronique, le cancer de la tête du pancréas, la cholangite bactérienne récurrente, l'obstruction chronique des voies biliaires (kyste biliaire, cholédochocèle ou pseudokyste du pancréas), la fibrose kystique ou une infection parasitaire (opistorchiase, clonorchiase, ascariose)
- les causes cardiovasculaires : l'insuffisance cardiaque droite, la péricardite constrictive et le syndrome de Budd-Chiari
- les causes idiopathiques.
Dans les pays développés, les causes les plus communes sont l'hépatite C, les maladies alcooliques et la stéato-hépatite non alcoolique. Dans les pays en développement, ce sont plutôt l'hépatite B et l'hépatite C.[9]
Physiopathologie
Plusieurs cellules jouent un rôle dans la cirrhose du foie. En plus des hépatocytes, on retrouve les cellules de la muqueuse sinusoïdale, telles que les cellules étoilées hépatiques (CÉH), les cellules endothéliales sinusoïdales (CES) et les cellules de Kupffer (CK). Les CÉH font partie de la paroi des sinusoïdes du foie, dans l'espace de Disse, et sont maintenus dans un état dormant en ne faisant que stocker la vitamine A. Les CES forment la muqueuse endothéliale et permettent l'échange de fluides et de nutriments entre les sinusoïdes et les hépatocytes, par la formation de fenestrations dans la paroi. Les CK sont des macrophages satellites présentatrices d'antigène qui tapissent également la paroi des sinusoïdes.[1][10]
À chaque blessure, les cellules hépatocytes sécrètent des facteurs paracrines qui viennent activer les CÉH pour stimuler leur activité à proliférer sous forme de myofibroblastes et à sécréter des TGF-béta pour maintenir un environnement inflammatoire. Les toxines étiologiques peuvent aussi directement activer les CÉH de la même manière. Les myofibroblastes vont alors se contracter, ce qui constricte les sinusoïdes. Ce processus augmente la résistance vasculaire du parenchyme et mène en chronique à une hypertension portale. Les myofibroblastes sont aussi à l'origine d'une production excessive de collagène type 1 et 3 dans l'espace de disse au lieu du collagène type 4 normalement retrouvé dans le foie[11]. En chronique, cette distorsion architecturale du foie altère les canaux biliaires intra-hépatiques et peut mener à une cholestase. Elle fait aussi perdre les fenestrations des sinusoïdes, ce qui diminue les échanges entre les hépatocytes et le plasma[5]. En plus de cette distorsion, on retrouve aussi des nodules parenchymateux formés suite à une régénération anormale du foie. On note finalement une réorganisation vasculaire par les dépôts de collagène mais aussi par augmentation de la production d'ET-1 et une diminution de production de NO. La vasoconstriction et la résistance intrahépatique résultante cause une diminution du flux sanguin vers les hépatocytes, de l'ascite et prédispose aussi à l'hypertension portale et à la formation de shunts porto-systémiques. Tous ces changements mènent à la progression en cirrhose, rendant le foie nodulaire et rigide.
Dans la circulation systémique et splanchnique, l'effet inverse se produit, avec une augmentation de la production de NO, entraînant une vasodilatation systémique et splanchnique et une diminution de la résistance vasculaire systémique ainsi que du flux sanguin efficace vers les reins[12]. Cela favorise l'activation du système rénine-angiotensine-aldostérone, entraînant une rétention de sodium et d'eau ainsi qu'une constriction vasculaire rénale. Le résultat est une circulation hyperdynamique. Ainsi, dans la cirrhose avec hypertension portale, il existe une déplétion des vasodilatateurs (principalement NO) intrahépatique mais un excès de NO extra-hépatique dans la circulation splanchnique et systémique, entraînant une vasoconstriction sinusoïdale et une vasodilatation splanchnique (systémique). Les collatérales contribuent également à la circulation hyperdynamique en augmentant le retour veineux vers le cœur.[1][13]
La perte de la fonction hépatique mène à 5 grandes conséquences. La perte de facteur de coagulation et de protéines anti-coagulantes peut être à l'origine de diathèse hémorragique en cas de décompensation, ou simplement causer des ecchymoses faciles. On retrouve aussi moins d'acides biliaires, ce qui diminue l'absorption de vitamines liposolubles dont les vitamines K, et ultimement les facteurs II, VII , IX et X et des protéines anticoagulantes naturelles C, S, dépendants de la vitamine K. On observe une augmentation d'œNICe libre par diminution d'albumine et une hypersensibilité des récepteurs aux œNICes et aux androgènes. Le dysfonctionnement hypothalamo-hypophysaire semble également être impliqué. Finalement, une augmentation de bilirubine non conjuguée par manque de conjugaison et par baisse d'excrétion est présente en cirrhose.
Dans les causes alcooliques, la réduction des réserves de NAD+ entraîne l'accumulation de lipides dans les hépatocytes. La production de dérivés réactif de l'oxygène (DRO) endommage aussi les hépatocytes. En chronique, cette condition peut mener à des dommages irréversibles et causer une cirrhose. On note aussi une défenestration de la paroi sinusoïdale en consommation chronique d'alcool, ce qui favorise la fibrose périsinusoïdale.[1][14]
Dans le cas d'une stéatose non alcoolique, on note une résistance à l'insuline permettant l'accumulation de lipides dans les hépatocytes. Ceci altère leur fonctionnement et leur intégrité structurelle. Similairement, l'hémochromatose et les transfusions sanguines fréquentes risquent de causer des dépôts de fer dans le foie, ce qui endommage les hépatocytes. On observe le même phénomène avec le cuivre chez les patients atteints de la maladie de Wilson, ainsi qu'avec l'accumulation d'alpha1-antitrypsine mal formés dans le foie, tel qu'observé chez les patients avec un déficit d'alpha1-antitrypsine[1]. Les causes biliaires impliquent un reflux de la bile vers le foie.[1]
Présentation clinique
Facteurs de risque
Les facteurs de risque sont :
- une hépatite B ou hépatite C
- un trouble d'usage lié à l'alcool chez l'homme (> 6 conso/j)[RC: 6,9[15]] et trouble d'usage lié à l'alcool chez la femme (>4 conso / j)[RC: 12,4[16]]
- l'obésité avec la NAFLD[RR: 1.2[17]]
- la NAFLD en combinaison avec le diabète de type 2[RR: 2.3[18]].
Questionnaire
La cirrhose peut être compensée, sans manifestations, ou par des manifestations non spécifiques :
- les symptômes initiaux seront[19]:
- de la fatigue[20]
- une inappétence[7]
- de la faiblesse
- des nausées et des vomissements[7]
- des crampes musculaires[21]
- des douleurs abdominales diffuses[7] ou un inconfort au quadrant supérieur droit[4].
Il est également possible de retrouver au questionnaire des éléments d'hyperoestrogénisme[1]:
- chez la femme :
- une aménorrhée
- une infertilité
- des saignements menstruels irréguliers
- chez l'homme :
- une baisse de libido
- une atrophie testiculaire
- une impuissance.
Quelques symptômes sont évocateurs d'une étiologie particulière[1] :
- déficience d'alpha1-antitrypsine: impuissance[22][23]
- hémochromatose: une fatigue, une polyurie, une polyphagie et une polydipsie
- causes biliaires: un prurit cutané, des urines foncées et des selles pâles de couleur argile
- maladie de Wilson: une dysarthrie, un changement de personnalité, une dépression.
Décompensation
Si la cirrhose est connue mais qu'elle est décompensée, les étiologies de décompensation doivent être questionnées:
- la non-compliance aux diurétiques ou à la restriction hydrosodée
- la constipation
- l'utilisation d'alcool
- les médicaments hépatotoxiques
- une infection récente.
Les symptômes suivants évoquent une décompensation[24][25][26]:
- syndrome hépatopulmonaire: dyspnée et platypnée
- syndrome hépatorénal : ascite, oligurie, fatigue
- encéphalopathie hépatique : altération de l'humeur, changement du sommeil, trouble de la concentration et de jugement
- saignement de varices œsophagiennes ou gastriques : hématémèse, méléna, fatigue, étourdissement, palpitations, vertiges, hypotension orthostatique
- péritonite bactérienne spontanée : fièvre, frissons, douleur abdominale diffuse.
Examen clinique
L'examen clinique permet d'objectiver les signes suivants[1][27] :
- l'examen est souvent normal lorsque la cirrhose est compensée[19]
- à l'apparence générale :
- une fonte musculaire et une perte de poids (signe initial[19])
- une gynécomastie et une atrophie testiculaire
- une perte ou asymétrie des poils
- présence de contractures de Dupuytren
- des ecchymoses
- aux signes vitaux :
- une tachypnée[28]
- une hypotension
- à l'examen cutané :
- un ictère
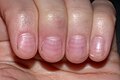
- des ongles de Terry
- des ongles de Muehrcke
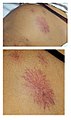
- des angiomes stellaires : surtout au tronc, au visage et aux membres supérieurs
- un érythème palmaire
- du clubbing
- à l'examen abdominal :
- une distention abdominale: peut être en raison de l'ascite et/ou de l'hépato-spénomégalie
- une hépatomégalie avec consistance ferme, ou une atrophie du foie si beaucoup de fibrose
- une splénomégalie
- une hernie ombilicale
- des signes d'irritation péritonéale
- à l'examen ORL :
- à l'examen des membres inférieurs:
-
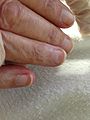
Ongles de Terry
-
Ictère
-
Angiome stellaire
-
Lignes de Muehrcke
-
Contracture de Dupuytren
-
Clubbing
Les signes suivants évoquent une complication cirrhotique :
- hypertension portale
- une ascite
- une splénomégalie
- un caput medusae
- des hémorroides
- un souffle de Cruveilhier-Baumgarten
- encéphalopathie hépatique
- un astérixis
- une confusion et une altération de l'état de conscience
- un fetor hepaticus.
- péritonite bactérienne spontanée
- une fièvre accompagnée de frissons
- une douleur abdominale diffuse
- une irritation péritonéale
Certaines étiologies ont des signes évocateurs[5]:
- maladie de Wilson :
- un parkisonisme avec trémor
- une dystonie
- des anneaux de Kayser-Fleischer
- des lunules d'azur
- hémochromatose : une hyperpigmentation cutanée
Examens paracliniques
Gravité
Les laboratoires suivants permettent d'évaluer la gravité de l'atteinte hépatique :
- aux test de fonction hépatique[1] : à noter que des taux normaux d'enzymes hépatiques n'excluent pas une cirrhose
- les ALT et AST légèrement à modérément élevés, avec un ratio habituellement ALT > AST, sauf pour l'alcool (2 AST : 1 ALT)
- élévation des GGT si l'étiologie est alcoolique
- phosphatase alcaline élevée si présence d'un trouble cholestatique (carcinome hépatocellulaire obstructif, CBP, CSP)
- INR élevé, temps de prothrombine et temps partiel de thromboplastine élevé
- hypoalbuminémie
- une gamma-globuline totale diminuée : rarement fait, mais étant la 2e protéine la plus abondante dans le sang, elle peut évaluer la sévérité de l'insuffisance hépatique
- bilirubine élevée, sauf en cas compensé où la bilirubine totale et conjuguée peut être normale
- à la FSC[1] :
- une hémoglobine diminuée (anémie normochrome)
- une leucopénie
- une thrombocytopénie (surtout dans les cas de splénomégalie[note 1])
- un ammoniac élevé: pertinent qu'en cas de suspicion d'encéphalopathie hépatique, un ammoniac élevé seul n'est pas très diagnostic
Les tests d'imagerie potentiels sont[1] :
| Modalité | Précisions | Images |
|---|---|---|
| Échographie abdominale | Peut détecter la nodularité et l'augmentation de l'échogénicité du foie, qui sont observées dans la cirrhose:
|
|
| Tomodensitométrie abdominale |
|
|
| Élastographie du foie (FibroscanMD) |
|
|
| Scintigraphie colloïdale de la rate et du foie |
|
La biopsie hépatique n'est pas toujours faite, seulement dans les cas où on a besoin d'observer de la fibrose et les nodules pour confirmer le diagnostic. On la fait après 6 mois d'abstinence alcoolique afin de voir les changements irréversibles[1][5].
Étiologies
Les tests suivants permettent de trouver l'étiologie de la cirrhose[1][7]:
- les ALT, AST[note 2], phosphatase alcaline, bilirubinémie
- la sérologie de l'hépatite B et C
- le bilan martial:
- pour l'hémochromatose : le bilan martial montre une élévation de fer, de transferrine (saturée à plus de 45%) et de ferritine, alors que la capacité férique de liaison totale est bas
- l'alpha-2-macroglobuline[34][35] : rarement fait, mais un taux sérique élevé indiquerait un syndrome néphrotique, alors qu'un taux faible indiquerait une atteinte hépatique sévère par sous-production hépatique. Ce dosage est surtout utilisé pour le diagnostic différentiel du syndrome néphrotique, de la cirrhose et du diabète.
- l'haptoglobine[36] : rarement fait, mais elle permet d'évaluer la présence d'une anémie hémolytique si les taux sont presque indétectable
- le dosage de l'a-1 antitrypsine: sera faible en cas de déficit
- l'EPS:
- absence de pic alpha dans le déficit en a-1 antitrypsine
- maladie à IgG4 associée à la CSP
- le cuivre sérique, urinaire et céruploplasmine: cuivre élevé et céruloplasmine diminuée dans la maladie de Wilson (à faire chez les sujets âgés de < 65 ans)
- le FAN, Ac anti-muscles lisses: positifs dans l'hépatite auto-immune type 1
- l'Ac anti-LKM: positifs dans l'hépatite auto-immune type 2 (autres négatifs)
- l'Ac anti-mitochondries: positifs dans la CBP
- l'imagerie
- la CPRM: normale pour une CBP, mais montrera pour une CSP une vésicule d'apparence perlée ou d'un arbre taillé
- une biopsie hépatique si l'étiologie demeure incertaine.
Complications
Les investigations suivantes sont faites pour évaluer la présence de complications :
- Une alpha-foetoprotéine élevée en cas de carcinome hépato-cellulaire (CHC).
- La TDM abdomino-pelvienne : peut détecter le carcinome hépatocellulaire et les lésions vasculaires.
- L'IRM avec contraste : peut aussi détecter le CHC et les lésions vasculaires avec plus de sensibilité et peut peut également être utilisée pour détecter[37][38] :
- le niveau de dépôt de fer et de graisse dans le foie pour l'hémochromatose et la stéatose
- 'obstruction biliaire si une cholangiographie magnétique par résonance (CPRM) est obtenue
- L'œsophagogastroduodénoscopie (OGD) peut montrer des varices dans l'œsophage ou l'estomac, signes d'hypertension portale[39].
- Aux tests respiratoires et au gaz sanguin[1][2] :
- une diminution de la saturation en oxygène par inadéquation de ventilation-perfusion
- une perte de la diffusion pulmonaire
- un syndrome hépato-pulmonaire comprenant une hypertension porto-pulmonaire et un hydrothorax hépatique
- Pour l'ascite[1] :
- une ponction d'ascite et une analyse du liquide d'ascite
- aux ions: une hyponatrémie secondaire à l'hypervolémique pourra être trouvée
- Pour le syndrome hépatorénale: la créatinine sera augmentée.
Histopathologie
Morphologiquement, la cirrhose est soit[1] :
- Micronodulaire : une cirrhose avec nodules uniformes de moins de 3 mm de diamètre. Elle est due à l'alcool, l'hémochromatose, l'obstruction veineuse hépatique, l'obstruction biliaire chronique, le pontage jéjuno-iléal et comprend la cirrhose infantile indienne.
- Macronodulaire : une cirrhose avec nodules irréguliers avec une variation supérieure à 3 mm de diamètre. Les causes comprennent les hépatites B et C, un déficit en alpha-1 antitrypsine et une cholangite biliaire primitive
- mixte : lorsque les caractéristiques de la cirrhose micronodulaire et macronodulaire sont présentes. habituellement, la cirrhose micronodulaire évolue vers la cirrhose macronodulaire au fil du temps.
À la biopsie du foie, les observations dépendent de la cause[1] :
- pour la stéatose hépatique non alcoolique : accumulation de lipides dans les hépatocytes
- pour la cirrhose alcoolique : corps de Mallory
- pour la déficience en a1-antitrypsine : ces molécules seront malformées.
Approche clinique
La plupart des patients porteur d'un cirrhose sont asymptomatique jusqu'à une décompensation. Lorsque les signes cliniques pour paracliniques sont évocateurs d'une cirrhose, les investigations de l'étiologie devraient débuter sur le champ[4].
Les étiologies les plus fréquentes sont[4]:
- les hépatites virales
- l'abus d'alcool
- la stéatose hépatique non alcoolique.
Les bilans initiaux sont[4]:
- les sérologies virales
- le bilan martial
- l'échographie abdominale
- les bilans de base comme la FSC, les ions, la créatinine
- le bilan hépatique complet (incluant l'AST, l'INR et l'albumine).
Selon les facteurs de risques, d'autres tests sont ajoutés[4].
Par la suite, les scores de MELD et de Child-Pugh sont utilisés pour stratifier la gravité de l'atteinte[4].
Si la cirrhose est connue mais qu'elle est décompensée, les étiologies de décompensation doivent être questionnées:
- la non-compliance aux diurétiques ou à la restriction hydrosodée
- la constipation
- l'utilisation d'alcool
- les médicaments hépatotoxiques
- une infection récente.
Diagnostic différentiel
Le diagnostic différentiel de la maladie dépend de la manifestation principale[1][40] :
- pour la distension abdominale
- l'obésité
- une constipation
- une grossesse
- une obstruction intestinale
- un globe vésical
- une organomégalie
- une tumeur abdominale de grand volume (un lymphome ou un cancer de l'ovaire)
- de la dialyse péritonéale
- de l'ascite secondaire à d'autres causes (carcinomatose péritonéale, une insuffisance cardiaque droite, tuberculose)
- pour l'insuffisance hépatique
- suite à une cause infectieuse
- la malaria
- la typhoide
- une infection au VIH
- une infection à l'EBV
- une hépatite virale
- suite à une néoplasie
- métaboliques
- substances
- suite à d'autres causes :
- suite à une cause infectieuse
Traitement
Afin de ralentir la progression de la cirrhose, les traitements généraux proposés sont les suivants[1] :
- traiter le facteur causal
- l'évitement de l'alcool, surtout si c'est une cirrhose alcoolique
- une diète équilibrée avec suppléments en vitamine B (B1, B9, B12)
- une perte de poids, surtout pour une stéatose hépatique non alcoolique où on vise au moins 7%[41]
- la vaccination contre l'hépatite A, l'hépatite B, l'influenza et les pneumococque
- l'évitement de médication hépatotoxique (ou réajuster la dose) et les suppléments diététiques et d'herbes naturelles
- un support psychosocial.
Le seul traitement définitif pour la cirrhose terminale est la transplantation hépatique. Ses critères sont[7]:
- une abstinence d'alcool > 6 mois
- < 65 ans
- cirrhoses décompensées réfractaires au traitement médical.
- un score de MELD > 15 ou un Child B > 7.
Les taux de survie à 1 an et à 5 ans après une transplantation hépatique sont d'environ 85 % et 72 %, respectivement. Une récidive de la maladie hépatique sous-jacente peut survenir après une greffe.[42]
Ajustement des médicaments
 | RxCirrhose.ca Ajustement des médicaments en insuffisance hépatique. |
On ajuste aussi la médication selon le stade CHILD-PUGH, notamment pour l'acétaminophène, l'acide valproïque, les alpha-bloquants, les analogue de la méglitinide, les antipsychotiques atypiques, les biguanides, les hypnotiques en Z, les inhibiteurs des alpha-glucosidases, l'ézétimibe, les inhibiteurs de la dipeptidyl peptidase-4, les les inhibiteurs de SGLT2, les AINS, les antidépresseurs (ISRS et ISRN), les anticoagulants oraux directs, les opioïdes, les IPP, les statines, le TMP-SMX, les macrolides, les fluoroquinolones et les prokinétiques.[43]
Suivi
Le suivi permet de prévenir ou dépister les complications. Il est fait aux 6 mois [7]:
- aux 6 mois[44] :
- échographie abdominale pour dépister le carcinome hépato-cellulaire
- mesure de l'alpha-fétoprotéine (AFP)[5] (non fait systématiquement)
- bilirubine, INR, albumine pour surveiller la fonction hépatique
- vaccination annuelle pour l'influenza et le pneumocoque
- endoscopie aux 2-3 ans pour dépister les varices et aux 6-12 mois s'il y a présence de varices
- prophylaxie antibiotique s'il y a ascite
- prophylaxie de béta-bloqueurs non-cardiosélectifs pour diminuer la pression portale s'il y a des varices.[45]
Selon l'étiologie de la cirrhose, d'autres tests de suivi peuvent être nécessaires (comme l'ALT chez ceux atteints d'hépatite virale).
Complications
On retrouve 6 causes principales de décompensation d'une cirrhose[46] :
- la non-compliance aux diurétiques ou à la restriction hydrosodée
- l'intoxication à l'alcool
- une infection aigue
- une constipation
- une thrombose de la veine porte
- l'évolution prévisible de la maladie.
Initialement, une cirrhose compensée peut montrer les complications suivantes:
- de l'ostéoporose[note 4][19]
- un état d'immunosuppression[47]
- un allongement du QT (47 %)[note 5][48]
La décompensation peut se manifester ainsi :
- en contexte d'hypertension portale :
- des varices oesophagiennes et leur possible rupture
- des varices rectales et leur possible rupture
- un syndrome hépato-rénal
- un syndrome hépato-pulmonaire
- une ascite
- une thrombose de la veine porte
- en contexte d'insuffisance hépatocellulaire :
- une encéphalopathie hépatique[note 6]
- une anasarque par hypoalbuminémie
- un ictère important par manque de conjugaison de la bilirubine par le foie
- une coagulopathie secondaire à l'augmentation de l'INR et la thrombopénie
D'autres complications qui ne sont pas nécessairement reliées à une décompensation peuvent être observées :
- une anémie microcytaire par saignement chronique de varices
- une anémie macrocytaire[note 7]
- une pancytopénie[note 8]
- un carcinome hépatocellulaire (CHC): 2 -5 % par année[44][note 9]
- la péritonite bactérienne spontanée[note 10].
Évolution
Au Canada, une étude effectuée entre 2000 et 2017 démontre que 40% des cirrhoses deviennent fatales après un suivi sur 5 ans[49]. Pour une cirrhose compensé, les modèles prédictifs estiment à 47% les chances de survie après 10 ans, mais celles-ci chutent à 16 % dès qu'un événement décompensant se produit[50]. On note d'ailleurs 4 à 10% de cas de décompensation par année chez ceux atteints de cirrhose induit par l'hépatite B et C ainsi que l'alcool. La survie moyenne pour une cirrhose compensée se situe autour de 12 ans, et diminue à 2 ans à la suite d'un épisode de décompensation. Ces taux de chances de survie expriment l'importance du travail de prévention chez les patients cirrhotiques. À noter que la cirrhose est reconnu comme une atteinte fibrosante généralement irréversible, mais le point tournant de cette pathologie reste encore à préciser; les stades précoces de la fibrose hépatique ont encore un potentiel de réversibilité, tel que démontrés par de récentes études, et permettent le maintien d'un bon niveau de vie fonctionnel[51][52]. Le traitement de la cause sous-jacente permet aussi de renverser le processus fibrosant; on rapporte un taux d'amélioration jusqu'à 88% après traitement par antiviraux des cas d'hépatite B et C, ainsi que jusqu'à 85% d'amélioration suite à une chirurgie bariatrique dans les cas de stéatose hépatique non alcoolique.[51]
Score de Child-Pugh
Le score de Child-Pugh est un outil utilisé pour évaluer la sévérité de la cirrhose et le pronostic selon la bilirubine totale, l'albumine sérique, l'INR, la présence d'ascite et la sévérité de l'encéphalopathie hépatique, avec un score maximal de 15. Selon ce score, il nous est possible de placer le pronostic de survie sur 3 classes[5]
| Paramètre | 1 point | 2 points | 3 points |
|---|---|---|---|
| Bilirubine totale, μmol/L | <34 | 34–50 | >50 |
| Albumine sérique, g/L | >35 | 28–35 | <28 |
| INR | <1.7 | 1.7–2.3 | > 2.3 |
| Ascite | Aucune | Légère (ou contrôlée par la médication) | Modérée, sévère ou réfractaire |
| Encéphalopathie hépatique | Aucune | Grade I–II | Grade III–IV |
| Points | Classe | Survie à 1 an | Survie à 2 ans |
|---|---|---|---|
| 5–6 | A | 100% | 85% |
| 7–9 | B | 80% | 60% |
| 10–15 | C | 45% | 35% |
Score de MELD
Le modèle de score de maladie hépatique en phase terminale (MELD) est un autre modèle utilisé pour prédire la mortalité à court terme des patients atteints de cirrhose. Il utilise la bilirubine sérique, la créatinine et l'INR pour prédire la mortalité au cours des trois prochains mois selon la formule suivante : 3,78[Ln bilirubine (mg/dL)] + 11,2 [Ln INR] + 9,57 [Ln creatinine (mg/dL)] + 6,43.[55]
| Valeur de l'analyse | Taux de mortalité à 3 mois |
|---|---|
| 40+ | 71,3% |
| 30-39 | 52,6% |
| 20-29 | 19,6% |
| 10-19 | 6,0% |
| <9 | 1,9% |
Ce score est entre autres utilisé aux États-Unis pour établir la priorité d'attribution des organes pour la transplantation hépatique chez les patients atteints de cirrhose.[55]
Prévention
Bien que les changements de mode de vie des patients ne puissent pas guérir la cirrhose, ces modifications comportementales peuvent empêcher ou au moins retarder la progression de la maladie et apporter un soulagement symptomatique. En plus des éléments décrits dans la section Traitement, les facteurs de style de vie modifiables incluent : [1][57]
- éviter complètement l'alcool
- éviter les fruits de mer crus et les crustacés
- vaccinations contre la pneumonie et la grippe
- réguler l'apport en protéines
- des supplément de vitamines et de minéraux.
En plus de ces modifications comportementales, on recommande aux États-Unis les dépistages suivants :
- l'hépatite B[58] : recommandé pour tous les candidats immigrants au Canada
- l'hépatite C[59] : recommandé chez les populations à risque
- l'hépatite D[60] : recommandé chez les patients atteints par l'hépatite B.
Notes
- ↑ Car il y aura séquestration splénique.
- ↑ Utile pour le calcul de plusieurs scores (comme le NAFLD fibrosis score).
- ↑ Aussi une complication de la cirrhose mais peut survenir seul.
- ↑ Par malabsorption de la vitamine D.
- ↑ La prévalence augmente avec la gravité de la cirrhose.
- ↑ L'encéphalopathie hépatique est un problème neurologique causé par l’accumulation de substances usuellement éliminées par le foie, notamment l’ammoniac. L’encéphalopathie hépatique se manifeste à divers degrés de dysfonction cérébrale, pouvant passer de subtiles anomalies de tests psychométriques à des manifestations cliniques évidentes, telles la confusion, la désorientation, la somnolence et de l’astérixis. Dans les cas sévères, le patient peut devenir comateux et inconscient et nécessité une prise en charge sur unité de soins intensifs pour obtenir un support respiratoire.
- ↑ En raison d'une carence en acide folique, d'une anémie hémolytique (anémie des éperons dans une maladie alcoolique grave du foie) et d'un hypersplénisme.
- ↑ Due à un hypersplénisme dans l'hypertension portale, une coagulation altérée, une coagulation intravasculaire disséminée et une hémosidérose chez les patients cirrhotiques pour différentes causes.
- ↑ Dû au cycle continu entre réparation et blessure qui favorise les mutations génétiques. Le CHC est le cancer primitif du foie le plus courant et son incidence est en augmentation. La cirrhose secondaire au VHB et au VHC est le facteur de risque le plus courant. Une surveillance systématique des patients cirrhotiques pour le développement d'un CHC est recommandée, avec une échographie abdominale de dépistage aux 6 mois. On peut noter dans certains cas de CHC un syndrome paranéoplasique, dû à une hypoglycémie par consommation de glucose des tumeurs, une diarrhée par sécrétion de peptides vasoactifs stimulant la sécrétion intestinale, et une hypercalcémie par sécrétion de PTH-like.
- ↑ Soit l’infection du liquide d'ascite sans cause évidente et directe d'inoculation, est une autre complication de la cirrhose. Elle résulte d’une modification de la flore gastro-intestinale et de l’immunité locale, entraînant une augmentation de la perméabilité mucosale. Le probabilité de translocation bactérienne augmente ainsi. Une fois contaminé, le liquide d’ascite devient un milieu favorable à la prolifération bactérienne. Les patients se présentant à l’urgence pour une péritonite bactérienne sévère peuvent même présenter des signes de sepsis et d’encéphalopathie hépatique secondaire. À noter que les patients atteints de cirrhose alcoolique présentent un risque accru de prolifération bactérienne de l'intestin grêle et de pancréatite, et les patients atteints d'une maladie hépatique chronique ont un taux plus élevé de formation de calculs biliaires, qui peuvent donner lieux à des infections.
Références
- Cette page a été modifiée ou créée le 2022/12/10 à partir de Hepatic Cirrhosis (StatPearls / Hepatic Cirrhosis (2021/11/05)), écrite par les contributeurs de StatPearls et partagée sous la licence CC-BY 4.0 international (jusqu'au 2022-12-08). Le contenu original est disponible à https://www.ncbi.nlm.nih.gov/pubmed/29494026 (livre).
- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 1,11 1,12 1,13 1,14 1,15 1,16 1,17 1,18 1,19 1,20 et 1,21 Bashar Sharma et Savio John, StatPearls, StatPearls Publishing, (PMID 29494026, lire en ligne)
- ↑ 2,0 et 2,1 J Saperia, Y DeWit, C M Booth et P Groome, « A222 INCREASING PREVALENCE OF CIRRHOSIS IN ONTARIO OVER THE LAST 20 YEARS: A POPULATION-BASED STUDY », Journal of the Canadian Association of Gastroenterology, vol. 1, no suppl_1, , p. 387–388 (ISSN 2515-2084 et 2515-2092, Central PMCID PMC6507675, DOI 10.1093/jcag/gwy008.223, lire en ligne)
- ↑ 3,0 et 3,1 « Cirrhose - RxCirrhose », sur www.rxcirrhose.ca (consulté le 19 décembre 2022)
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 et 4,6 (en-US) Andrew Smith, Katrina Baumgartner et Christopher Bositis, « Cirrhosis: Diagnosis and Management », American Family Physician, vol. 100, no 12, , p. 759–770 (lire en ligne)
- ↑ 5,0 5,1 5,2 5,3 5,4 et 5,5 L'appareil digestif: Des sciences fondamentales à la clinique, Les Presses de l'Université de Montréal, (ISBN 978-2-7606-3627-9 et 978-2-7606-3624-8, DOI 10.2307/j.ctv69tdtm, lire en ligne)
- ↑ 6,0 6,1 6,2 et 6,3 « Login - My Account - Essential Evidence Plus », sur www.essentialevidenceplus.com (consulté le 31 décembre 2022)
- ↑ 7,0 7,1 7,2 7,3 7,4 7,5 7,6 7,7 et 7,8 « Cirrhose », sur lanthiermed.com (consulté le 31 décembre 2022)
- ↑ « Table: Causes d'obstruction des voies biliaires », sur Édition professionnelle du Manuel MSD (consulté le 7 avril 2023)
- ↑
- ↑ Filip Braet et Eddie Wisse, « Structural and functional aspects of liver sinusoidal endothelial cell fenestrae: a review », Comparative Hepatology, vol. 1, no 1, , p. 1 (ISSN 1476-5926, PMID 12437787, DOI 10.1186/1476-5926-1-1, lire en ligne)
- ↑ Jennifer Lehmann, Michael Praktiknjo, Mette Juul Nielsen et Robert Schierwagen, « Collagen type IV remodelling gender‐specifically predicts mortality in decompensated cirrhosis », Liver International, vol. 39, no 5, , p. 885–893 (ISSN 1478-3223, PMID 30739387, Central PMCID 6594031, DOI 10.1111/liv.14070, lire en ligne)
- ↑ Savio John et Paul J. Thuluvath, « Hyponatremia in cirrhosis: pathophysiology and management », World Journal of Gastroenterology, vol. 21, no 11, , p. 3197–3205 (ISSN 2219-2840, PMID 25805925, Central PMCID 4363748, DOI 10.3748/wjg.v21.i11.3197, lire en ligne)
- ↑ Jan Lata, « Hepatorenal syndrome », World Journal of Gastroenterology, vol. 18, no 36, , p. 4978–4984 (ISSN 2219-2840, PMID 23049205, Central PMCID 3460323, DOI 10.3748/wjg.v18.i36.4978, lire en ligne)
- ↑ I. V. Deaciuc, N. B. D'Souza, F. Fortunato et D. B. Hill, « Alcohol-induced sinusoidal endothelial cell dysfunction in the mouse is associated with exacerbated liver apoptosis and can be reversed by caspase inhibition », Hepatology Research: The Official Journal of the Japan Society of Hepatology, vol. 19, no 1, , p. 85–97 (ISSN 1386-6346, PMID 11137483, DOI 10.1016/s1386-6346(00)00087-5, lire en ligne)
- ↑ https://pubmed.ncbi.nlm.nih.gov/31464740/
- ↑ https://pubmed.ncbi.nlm.nih.gov/31464740/
- ↑ https://pubmed.ncbi.nlm.nih.gov/32353039/
- ↑ https://pubmed.ncbi.nlm.nih.gov/32353039/
- ↑ 19,0 19,1 19,2 et 19,3 (en-US) Joel J. Heidelbaugh et Michael Bruderly, « Cirrhosis and Chronic Liver Failure: Part I. Diagnosis and Evaluation », American Family Physician, vol. 74, no 5, , p. 756–762 (lire en ligne)
- ↑ Mark G. Swain, « Fatigue in liver disease: pathophysiology and clinical management », Canadian Journal of Gastroenterology = Journal Canadien De Gastroenterologie, vol. 20, no 3, , p. 181–188 (ISSN 0835-7900, PMID 16550262, Central PMCID 2582971, DOI 10.1155/2006/624832, lire en ligne)
- ↑ P. J. Marotta, I. W. Graziadei et C. N. Ghent, « Muscle cramps: a 'complication' of cirrhosis », Canadian Journal of Gastroenterology = Journal Canadien De Gastroenterologie, vol. 14 Suppl D, , p. 21D–25D (ISSN 0835-7900, PMID 11110608, DOI 10.1155/2000/214916, lire en ligne)
- ↑ Vignan Manne et Kris V. Kowdley, « Alpha1-Antitrypsin Deficiency: A Cause of Chronic Liver Disease », Clinics in Liver Disease, vol. 24, no 3, , p. 483–492 (ISSN 1557-8224, PMID 32620284, DOI 10.1016/j.cld.2020.04.010, lire en ligne)
- ↑ Marcelle Meseeha et Maximos Attia, StatPearls, StatPearls Publishing, (PMID 28723059, lire en ligne)
- ↑ « Hypertension portale - Troubles hépatiques et biliaires », sur Édition professionnelle du Manuel MSD (consulté le 8 avril 2023)
- ↑ (en) « Hepatorenal Syndrome | Cirrhosis and Complications | Liver | UPMC », sur UPMC | Life Changing Medicine (consulté le 8 avril 2023)
- ↑ « Péritonite bactérienne spontanée - Troubles hépatiques et biliaires », sur Édition professionnelle du Manuel MSD (consulté le 8 avril 2023)
- ↑ Sandra Van den Velde, Frederik Nevens, Paul Van Hee et Daniel van Steenberghe, « GC-MS analysis of breath odor compounds in liver patients », Journal of Chromatography. B, Analytical Technologies in the Biomedical and Life Sciences, vol. 875, no 2, , p. 344–348 (ISSN 1570-0232, PMID 18938115, DOI 10.1016/j.jchromb.2008.08.031, lire en ligne)
- ↑ S. J. Lustik, A. K. Chhibber, J. W. Kolano et I. A. Hilmi, « The hyperventilation of cirrhosis: progesterone and estradiol effects », Hepatology (Baltimore, Md.), vol. 25, no 1, , p. 55–58 (ISSN 0270-9139, PMID 8985264, DOI 10.1002/hep.510250110, lire en ligne)
- ↑ Hisham Tchelepi, Philip W. Ralls, Randall Radin et Edward Grant, « Sonography of diffuse liver disease », Journal of Ultrasound in Medicine: Official Journal of the American Institute of Ultrasound in Medicine, vol. 21, no 9, , p. 1023–1032; quiz 1033–1034 (ISSN 0278-4297, PMID 12216750, DOI 10.7863/jum.2002.21.9.1023, lire en ligne)
- ↑ A. Giorgio, P. Amoroso, G. Lettieri et P. Fico, « Cirrhosis: value of caudate to right lobe ratio in diagnosis with US », Radiology, vol. 161, no 2, , p. 443–445 (ISSN 0033-8419, PMID 3532188, DOI 10.1148/radiology.161.2.3532188, lire en ligne)
- ↑ « Cirrhose - Troubles hépatiques et biliaires », sur Édition professionnelle du Manuel MSD (consulté le 9 avril 2023)
- ↑ « Scintigraphie - Sujets spéciaux », sur Édition professionnelle du Manuel MSD (consulté le 9 avril 2023)
- ↑ Chakraborty, Dhritiman Sunil, Hejjaji Venkataramarao Mittal, Bhagwant Rai Bhattacharya, Anish Singh, Baljinder Chawla, Yogesh, Role of Tc99m sulfur colloid scintigraphy in differentiating non-cirrhotic portal fibrosis from cirrhosis liver, Medknow Publications, (OCLC 841505592, lire en ligne)
- ↑ « A2-macroglobuline - Glossaire | Laboratoire, radiologie, sommeil et génétique | Biron », sur www.biron.com (consulté le 8 avril 2023)
- ↑ « ALPHA 2 MACROGLOBULINE (Nationale) », sur Dynacare.ca (consulté le 8 avril 2023)
- ↑ « Haptoglobin - Health Encyclopedia - University of Rochester Medical Center », sur www.urmc.rochester.edu (consulté le 8 avril 2023)
- ↑ H. L. Bonkovsky, R. B. Rubin, E. E. Cable et A. Davidoff, « Hepatic iron concentration: noninvasive estimation by means of MR imaging techniques », Radiology, vol. 212, no 1, , p. 227–234 (ISSN 0033-8419, PMID 10405746, DOI 10.1148/radiology.212.1.r99jl35227, lire en ligne)
- ↑ Aliya Qayyum, Jeffrey S. Goh, Sanjay Kakar et Benjamin M. Yeh, « Accuracy of liver fat quantification at MR imaging: comparison of out-of-phase gradient-echo and fat-saturated fast spin-echo techniques--initial experience », Radiology, vol. 237, no 2, , p. 507–511 (ISSN 0033-8419, PMID 16244259, DOI 10.1148/radiol.2372040539, lire en ligne)
- ↑ Arie Regev, Mariana Berho, Lennox J. Jeffers et Clara Milikowski, « Sampling error and intraobserver variation in liver biopsy in patients with chronic HCV infection », The American Journal of Gastroenterology, vol. 97, no 10, , p. 2614–2618 (ISSN 0002-9270, PMID 12385448, DOI 10.1111/j.1572-0241.2002.06038.x, lire en ligne)
- ↑ « Cirrhosis - WikEM », sur wikem.org (consulté le 20 mars 2023)
- ↑ Kittichai Promrat, David E. Kleiner, Heather M. Niemeier et Elizabeth Jackvony, « Randomized controlled trial testing the effects of weight loss on nonalcoholic steatohepatitis », Hepatology (Baltimore, Md.), vol. 51, no 1, , p. 121–129 (ISSN 1527-3350, PMID 19827166, Central PMCID 2799538, DOI 10.1002/hep.23276, lire en ligne)
- ↑ Carmen Vinaixa, Angel Rubín, Victoria Aguilera et Marina Berenguer, « Recurrence of hepatitis C after liver transplantation », Annals of Gastroenterology, vol. 26, no 4, , p. 304–313 (ISSN 1108-7471, PMID 24714603, Central PMCID 3959489, lire en ligne)
- ↑ « Médicaments - RxCirrhose », sur www.rxcirrhose.ca (consulté le 20 mars 2023)
- ↑ 44,0 et 44,1 Hélène Caster et Gilles Pomier Layrargues, « Quand l'hépatite se complique ... prise en charge de la cirrhose », Le médecin du Québec, vol. 47, no 4, (lire en ligne)
- ↑ (en) Sofia Simona Jakab et Guadalupe Garcia-Tsao, « Screening and Surveillance of Varices in Patients With Cirrhosis », Clinical Gastroenterology and Hepatology, vol. 17, no 1, , p. 26–29 (DOI 10.1016/j.cgh.2018.03.012, lire en ligne)
- ↑ Dina Mansour et Stuart McPherson, « Management of decompensated cirrhosis », Clinical Medicine (London, England), vol. 18, no Suppl 2, , s60–s65 (ISSN 1473-4893, PMID 29700095, Central PMCID 6334027, DOI 10.7861/clinmedicine.18-2-s60, lire en ligne)
- ↑ Agustín Albillos, Margaret Lario et Melchor Álvarez-Mon, « Cirrhosis-associated immune dysfunction: distinctive features and clinical relevance », Journal of Hepatology, vol. 61, no 6, , p. 1385–1396 (ISSN 1600-0641, PMID 25135860, DOI 10.1016/j.jhep.2014.08.010, lire en ligne)
- ↑ M. Bernardi, S. Calandra, A. Colantoni et F. Trevisani, « Q-T interval prolongation in cirrhosis: prevalence, relationship with severity, and etiology of the disease and possible pathogenetic factors », Hepatology (Baltimore, Md.), vol. 27, no 1, , p. 28–34 (ISSN 0270-9139, PMID 9425913, DOI 10.1002/hep.510270106, lire en ligne)
- ↑ (en) Peter L. Wang, Maya Djerboua et Jennifer A. Flemming, « Cause-specific mortality among patients with cirrhosis in a population-based cohort study in Ontario (2000–2017) », Hepatology Communications, vol. 7, no 7, (ISSN 2471-254X, DOI 10.1097/HC9.0000000000000194, lire en ligne)
- ↑ Russell Wiesner, Erick Edwards, Richard Freeman et Ann Harper, « Model for end-stage liver disease (MELD) and allocation of donor livers », Gastroenterology, vol. 124, no 1, , p. 91–96 (ISSN 0016-5085, PMID 12512033, DOI 10.1053/gast.2003.50016, lire en ligne)
- ↑ 51,0 et 51,1 (en-US) Andrew Smith, Katrina Baumgartner et Christopher Bositis, « Cirrhosis: Diagnosis and Management », American Family Physician, vol. 100, no 12, , p. 759–770 (lire en ligne)
- ↑ (en) « Living with Cirrhosis of the Liver: Life Expectancy, Risk Factors, Diet », sur Griswold Home Care (consulté le 29 juin 2023)
- ↑ Child, C.G. and Turcotte, J.G. (1964) Surgery and Portal Hypertension. In: Child. C.G., Ed., The Liver and Portal Hypertension, Saunders, Philadelphia, 50-64.
- ↑ (en) « Child–Pugh score - Wikipedia », sur en.wikipedia.org (consulté le 21 mai 2019)
- ↑ 55,0 et 55,1 (en) « Understanding MELD Score for Liver Transplant | UPMC », sur UPMC | Life Changing Medicine (consulté le 27 mai 2023)
- ↑ « Table: Score MELD et mortalité », sur Édition professionnelle du Manuel MSD (consulté le 27 mai 2023)
- ↑ (en-US) Andrew Smith, Katrina Baumgartner et Christopher Bositis, « Cirrhosis: Diagnosis and Management », American Family Physician, vol. 100, no 12, , p. 759–770 (lire en ligne)
- ↑ (en) Carla S. Coffin, Scott K. Fung, Fernando Alvarez et Curtis L. Cooper, « Management of Hepatitis B Virus Infection: 2018 Guidelines from the Canadian Association for the Study of Liver Disease and Association of Medical Microbiology and Infectious Disease Canada », Canadian Liver Journal, vol. 1, no 4, , p. 156–217 (ISSN 2561-4444 et 2561-4444, PMID 35992619, Central PMCID PMC9202759, DOI 10.3138/canlivj.2018-0008, lire en ligne)
- ↑ Public Health Agency of Canada, « Hepatitis C: For health professionals », sur www.canada.ca, (consulté le 27 mai 2023)
- ↑ « Hépatite D - Troubles hépatiques et biliaires », sur Édition professionnelle du Manuel MSD (consulté le 29 juin 2023)